Швидкість хімічних реакцій
Міністерство науки та освіти України
Біловодський ліцей «Лідер»
Розробка
медіа-уроку у 9 класі
з поглибленим вивченням хімії
Тема: «Поняття про хімічну кінетику. Швидкість хімічної реакції»
Вчитель хімії, вчитель-методист
Біловодського ліцею
«Лідер»
Старобільського району
Луганської області
Філоненко Ж.Д.
2022 р.
Тема уроку: Поняття про хімічну кінетику
Швидкість хімічної реакції.
Мета: Сформувати поняття про хімічну кінетику, швидкість хімічної реакції та фактори, що впливають на неї; досліджувати залежність швидкості від природи реагуючих речовин, концентрації, площі зіткнення, температури шляхом проведення експерименту; розвивати в учнів вміння спостерігати та аналізувати.
Обладнання: комп'ютер, мультимедійний проектор;
Реактиви: купрум (ІІ) сульфат, залізні стружки, барій хлорид, сульфатна кислота; реактиви необхідні для проведення лабораторного досліду №11 підручника.
Хід уроку:
І. Актуалізація опорних знань. Мотивація навчальної діяльності.
На попередніх уроках ми розглянули різні підходи до класифікації хімічних реакцій і вкотре переконалися у їхньому різноманітті.
Перед вами схеми реакцій: Слайд №1
ВаС І 2 +Н 2 SO 4 →
CuSO 4 +Fe→
AI+O 2 →
CaCO 3 →
Складіть рівняння за заданими схемами і визначте до якого типу належить кожна з цих реакцій, якщо за основу класифікації взяті наступні критерії:
а) зміна кількості реагентів та продуктів реакції;
б) зміна ступенів окиснення елементів.
Яку інформацію несе нам рівняння реакції? Чи достатньо її, щоб успішно здійснювати той чи інший процес?
А чи можемо ми сказати, наскільки швидко протікає та чи інша реакція?
Демонстрація дослідів:
1) взаємодія барій хлориду з сульфатною кислотою;
2) взаємодія заліза з купром (ІІ) сульфатом.
- 1-я реакція відбулася миттєво, у другій пробірці поки що без змін.
*Відеофрагмент «Взаємодія заліза із Купрум сульфатом». Слайд №2
Висновок: друга реакція йде набагато повільніше.
А про що вам каже ваш життєвий досвід?
Чи всі реакції здійснюються з однаковими швидкостями?
- (горіння природного газу, скисання молока, іржавіння заліза,
взаємодія натрію із водою).

Усі реакції протікають у часі. Перетворення граніту на пісок триває століттями. Також довго відбуваються реакції, які забезпечують нас нафтою, вугіллям. Століттями зберігають свою красу вироби із золота, полотна великих художників. Слайд №3

Виготовлена понад 1600 років тому в Індії залізна колона (з високим ступенем чистоти) висотою 7,21 м. досі не пошкоджена корозією. Слайд№4
А символ Парижа – «Ейфелева вежа» іржавіє і руйнується Щоб уберегти її від руйнування, її постійно лікують. Її фарбували вже 18 разів, через що її вага (3000т.) збільшується щоразу на 70т. Слайд№5

Чи важливо знати, з якою швидкістю йде реакція?
-Це необхідно, щоб керувати хімічними процесами як на виробництві, так і в лабораторії. Корисні треба вміти прискорювати, а шкідливі уповільнювати. А для цього треба розуміти, що таке "швидкість хімічної реакції". Сьогодні ви про це дізнаєтесь.
ІІ. Вивчення нового матеріалу
Тема уроку: Поняття хімічної кінетики. Швидкість хімічної реакції. Слайд№6
Чому кінетика? Слайд №7
Основні положення:
Кінетика - наука про швидкість і механізми процесів
Хімічна кінетика вивчає швидкість і механізми хімічних реакцій
То що таке швидкість?
Давайте разом знайдемо відповідь на це питання. І нехай у цьому пошуку нам допоможе хімічний експеримент. А головною ідеєю уроку стануть слова великого хіміка Д.І. Менделєєва:
«Досвід – єдиний вірний шлях питати природу і чути відповідь у її лабораторії». Слайд №8
Отже дослідження хімічних реакцій буде сьогодні невід'ємною частиною нашої колективної роботи.
Що у вашому розумінні «швидкість» ?
Це поняття відоме вам із курсу фізики. (Евристична бесіда)
Швидкість - це величина, яка чисельно дорівнює шляху, пройденого тілом за одиницю часу
V =![]() Слайд№9
Слайд№9
Ми живемо у динамічному світі. Об'єкти живої та неживої природи рухаються з різною швидкістю: амеба 0,2 мм. на хвилину, а найшвидша дика кішка гепард розвиває швидкість 60 км. на годину, по-різному проростає насіння кинуте в землю, з різною швидкістю рухається транспорт.
Швидкість показує зміну будь-якої величини у часі . Слайд №10
Що ж змінюється за хімічних реакцій?
- вміст речовин у реакційній суміші, тобто їх концентрація.
Швидкість хімічної реакції - це величина, що показує, як змінюється концентрація вихідних речовин або продуктів реакції за одиницю часу.
![]()
Припустимо, що початкова концентрація сульфур (IV) оксиду в реакції окислення його в сульфур ( VI ) оксид була 5 моль/літр, а через 30 секунд стала 2 моль/літр. У цьому випадку концентрація вихідної речовини змінилася на С2 -С1=5-2=3моль/л, а швидкість реакції в даний момент становитиме:
V = ![]() = 0,01 моль/л * сек.
= 0,01 моль/л * сек.
При хімічних реакціях зміна концентрації речовин відбувається нерівномірно. Швидкість у кожний момент може бути неоднаковою. Тому визначають середню швидкість за якийсь проміжок часу.
**Швидкість реакції в гомогенному (г-г, р-р) та гетерогенному середовищі (т-г, г- р., т -р)
V гом . =![]() Слайд№12
Слайд№12
Найбільший інтерес представляють реакції, що протікають у гомогенному середовищі, де вони йдуть у всьому об’ємі.
Чому реакції йдуть із різними швидкостями?
Відповідь у розумінні механізму хімічної реакції.
Що потрібно для того, щоб почалася реакція?
- Однією з умов початку реакції є приведення речовин у зіткнення
- Щоб між частинками (молекулами, іонами) вихідних речовин відбулася взаємодія, необхідне їх зіткнення.
Молекулярно-кінетична теорія газів та рідин дає можливість підрахувати число зіткнень між молекулами тих чи інших речовин. Якщо скористатися результатами таких підрахунків, то виявиться, що кількість зіткнень за звичайних умов така велика, що всі реакції повинні протікати практично миттєво. Однак не всі реакції закінчуються швидко, тому що утворення нових речовин можливе тільки між молекулами, що мають достатній запас енергії, необхідної для розриву або послаблення зв'язків між атомами в молекулах вихідних речовин.
Такі молекули називаються активними, а мінімальна енергія, яка потрібна для початку реакції, називається енергією активації. Слайд№13
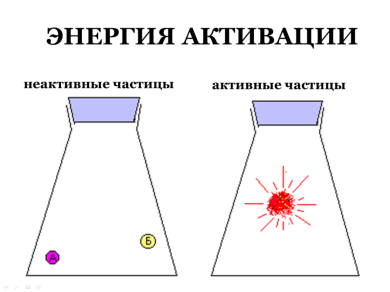
Величина енергії активації залежить від природи реагуючих речовин і є характеристикою кожної реакції.
Слайд№14
Величина енергії активації
Еакт<60кДж – швидкість реакції дуже велика (вибух)
Еакт.>150 кДж – швидкість реакції дуже мала або
ця реакція практично не відбувається
Зазвичай реакції між речовинами з міцними ковалентними зв'язками характеризуються великими значеннями активації енергії і йдуть повільно. Малими значеннями енергії активації та дуже великими швидкостями характеризуються іонні взаємодії у розчинах.
Слайд №15
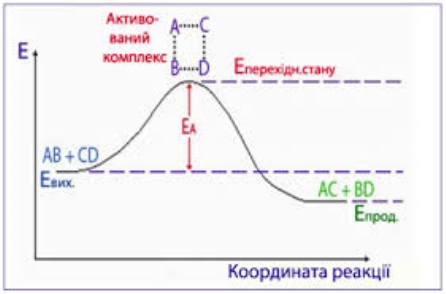
Щоб реагуючі речовини А і В утворили продукти реакції С і D, вони повинні подолати енергетичний бар'єр (на це треба витратити енергію активації).
При цьому в ході реакції з частинок реагуючих речовин утворюється проміжне нестійке угруповання - активований комплекс, який потім розпадається з утворенням кінцевих продуктів.
Зазвичай молекули мають певний середній запас енергії. Та кількість енергії, яку необхідно повідомити молекулі, щоб зробити її активною для реакції, є енергія активації. Згідно із законом Максвелла-Больцмана, завжди існують молекули з високою енергією достатньою д подолання енергетичного бар'єру. Сл.№16
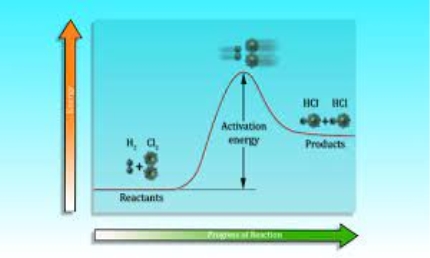
- Від чого залежить швидкість хімічної реакції?
Робота у групах
Вивчення залежності швидкості реакції від різних факторів.
(Кожна група отримує завдання та інструктивний лист для проведення дослідів та інструктаж з техніки безпеки).
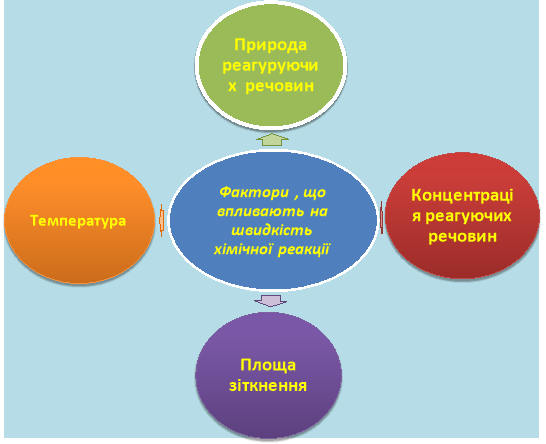
1-ша група з'ясовує залежність швидкості від природи реагуючих речовин. 2-а – від концентрації, 3-я – від площі дотику, 4-а – від температури.
За результатами роботи кожна група звітує.
На підтвердження дії кожного фактора на швидкість хімічної реакції демонструються відповідні відеофрагменти та складається схема «Фактори, що впливають на швидкість хімічної реакції» Слайд№17
![]()
ІІІ. Закріплення матеріалу вивченого на уроці .
1.Що таке швидкість хімічної реакції ?
2. Завдання на обчислення швидкості реакції . Слайд№18
Обчислити середню швидкість реакції, якщо через 10 секунд після початку реакції концентрація тіосульфату натрію була 0,025 моль/літр, а через 20 секунд стала 0,015 моль/літр
3. Що вивчає кінетика?
4. Що таке енергія активації? Енергетичний бар'єр?
5.Чому на хімічних підприємствах використовують повітря збагачене киснем?
6. Про що свідчить виділення великої кількості диму із фабричних труб?
7. Які фактори впливають на швидкість хімічної реакції?
V. Висновки з уроку.
Сьогодні на уроці ви дізналися:
*хімічні реакції протікають з різними швидкостями
*на шляху всіх частинок, що вступають у реакцію, є енергетичний бар'єр, рівний енергії активації, подолавши який частинки вихідних речовин утворюють нові речовини
*швидкість реакції залежить від факторів:
- природи реагуючих речовин
- Концентрації
- площі стикання
- температури.
Надалі ви дізнаєтеся про те, яким законам підпорядковується цей вплив, з іменами яких вчених пов'язане їх відкриття та як знання механізмів перебігу реакцій дозволяє успішно керувати хімічними процесами.


про публікацію авторської розробки
Додати розробку
