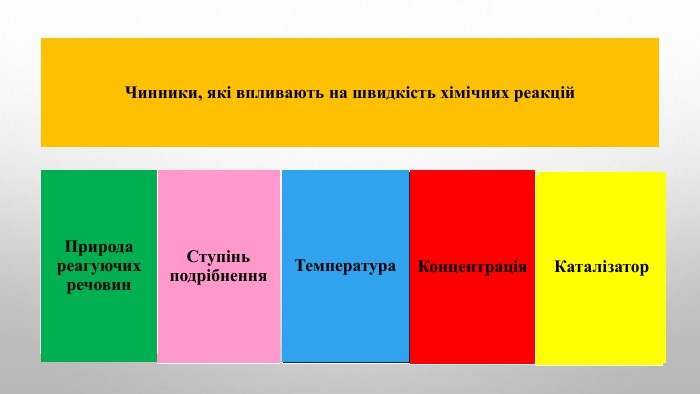
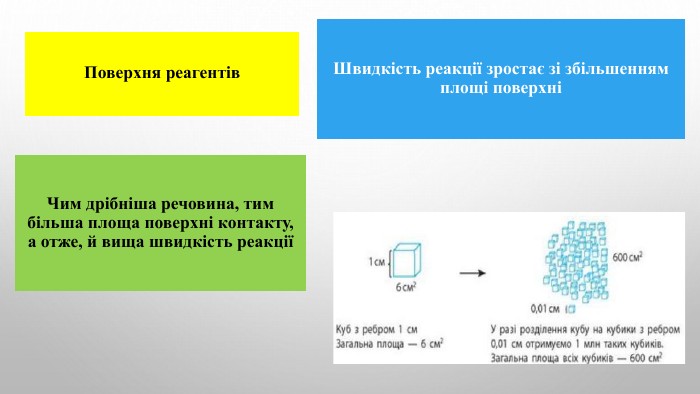
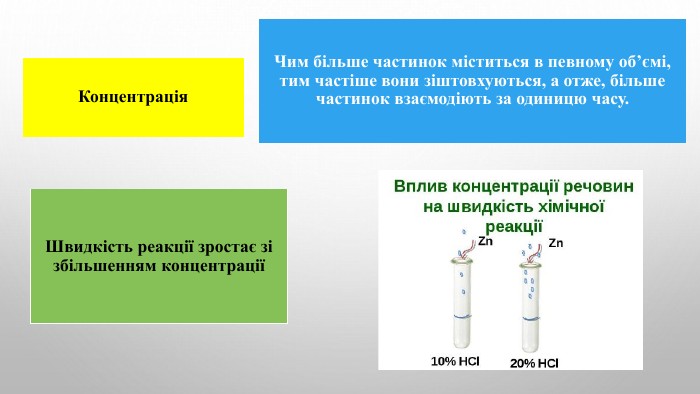
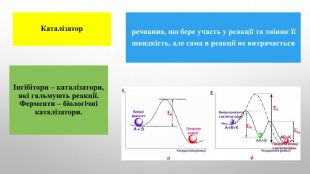
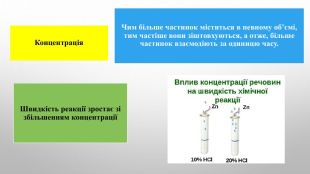
Швидкість хімічної реакції. Залежність швидкості хімічної реакції від різних чинників
Про матеріал
Презентація до уроку хімії в 9-му класі за темою "Швидкість хімічної реакції. Залежність швидкості реакції від різних чинників". Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


![Швидкість реакції зміна концентрації речовини за одиницю часу. U – швидкість хімічної реакції, [моль/л∙с]n – кількість речовини, [моль]V - об’єм, [л], t – час [с]Кінетика - галузь хімічної науки, що вивчає швидкість хімічної реакції Швидкість реакції зміна концентрації речовини за одиницю часу. U – швидкість хімічної реакції, [моль/л∙с]n – кількість речовини, [моль]V - об’єм, [л], t – час [с]Кінетика - галузь хімічної науки, що вивчає швидкість хімічної реакції](/uploads/files/4592833/359750/413458_images/3.jpg)