Склад і властивості основних класів неорганічних сполук. Повторення
Склад і властивості основних класів
неорганічних сполук
Навчально-освітня мета: продовжувати формувати ключову компетентність як фундамент оволодіння знаннями, уміннями, досвідом навчального матеріалу 9 класу, актуалізувати знання учнів про класи неорганічних речовин, систематизувати уявлення про особливості властивостей речовин кожного класу, формувати в учнів позитивну мотивацію навчання, роз’яснювати важливість та значущість здобутих знань у суспільному та особистому житті.
Тип уроку: узагальнення та систематизація знань.
Предметна компетентність: продовжувати формувати ключову компетентність як фундамент оволодіння знаннями, уміннями, досвідом навчального матеріалу 9 класу, актуалізувати знання учнів про класи неорганічних речовин, систематизувати уявлення про особливості властивостей речовин кожного класу, формувати в учнів позитивну мотивацію навчання, роз’яснювати важливість та значущість здобутих знань у суспільному та особистому житті.
Ключові компетентності: спілкування державною мовою, математична компетентність, основні компетентності у природничих науках і технологіях, соціальна та громадянська компетентності.
Хід уроку
І. Організаційний етап
ІІ. Актуалізація опорних знань
1. На які групи поділені неорганічні речовини?
2. Чим відрізняються прості речовини від складних?
3. На які класи поділені складні речовини?
4. Як відрізнити оксиди від інших класів?
5. Запишіть формули кислот:
1)одноосновна, сильна, безоксигенова;
2) одноосновна, сильна, оксигеновмісна;
3) трьохосновна, середньої сили, оксигеновмісна;
4) двохосновна, сильна оксигеновмісна;
5) двохосновна, слабка, нерозчинна у воді;
6) двохосновна, слабка, входить до складу мінеральних вод.
6.Які речовини називаються основами?
7.Солі — це...
III. Повторення вивченого матеріалу
На сьогодні відомо понад 10 млн. сполук, серед яких понад 100 тис. – неорганічні. Для зручності вивчення їх класифікують – об’єднують у групи, залежно від будови та властивостей. Знаючи властивості класу, можна легко перенести їх на окремих представників.
Клас сполук – група речовин, що об’єднані за певною спільною ознакою.
Неорганічні сполуки – це сполуки, які утворюються всіма хімічними елементами (крім більшості органічних сполук Карбону).
За хімічним складом неорганічні речовини поділяються на прості та складні.
Прості речовини (утворені атомами одного хімічного елемента) за хімічними властивостями поділяються на метали та неметали.
Складні речовини (утворені атомами різних хімічних елементів) за складом та хімічними властивостями поділяються на оксиди, основи, кислоти та солі.
Схема 1
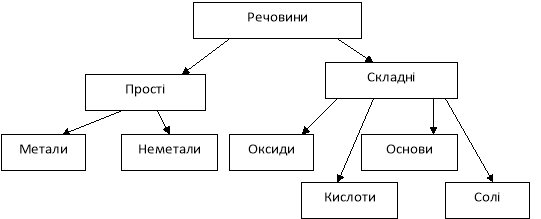
Класифікація складних неорганічних речовин заснована на відмінностях в їх складі. Найважливіші класи неорганічних речовин оксиди, кислоти, основи і солі.
Оксиди — речовини, що складаються з двох елементів, одним з яких є Оксиген.
Приклад:
Fe2 O3, SO2.
Основи — складні речовини, до складу яких входять атоми металів і одна або дві гідроксогрупи OH.
Приклад:
Ca(OH)2, KOH.
Зверни увагу!
Деякі схожі за складом сполуки відносять до класу амфотерних гідроксидів. Їх формули треба запам'ятати:
Zn(OH)2, Be(OH)2.
Амфотерними гідроксидами є і сполуки, які містять атоми металів і три або чотири гідроксогрупи:
Al(OH)3, Pb(OH)4.
Кислоти — речовини, що містять атоми Гідрогену, які здатні заміщуватися на атоми металу, і кислотні залишки.
Приклад:
HNO3, H2 S.
Солі — складні речовини, до складу яких входять атоми металів і кислотні залишки.
Приклад:
NaCl, Ca3 (PO4)2.
Узагальнення та систематизація знань
1. Хімічний диктант № 1
Розподіліть формули речовин відповідно до класу неорганічних сполук:
HCN, LiOH, K CrO 2 4, Na O 2 , HClO, Cl O 2 7, Fe(OH)3 , Na S 2 .
2. Хімічний диктант № 2
Розподіліть формули оксиди відповідно до їх класифікації: Cr O 2 3, CrO,
MnO2, Mn O 2 7, SO3, BaO.
|
Основні оксиди |
Амфотерні оксиди |
Кислотні оксиди |
|
|
|
|
3. Гра «Хрестики-нулики» (використання мультимедійної дошки)
а) Виберіть рядок або діагональ, де вказано формули сульфідів:
|
K2 S |
MgSO3 |
ZnS |
|
Na2 SO3 |
BaS |
SO2 |
|
BaSO4 |
SO3 |
CuS |
б) Виберіть рядок або діагональ, де вказано формули лугів:
|
KOH |
Al(OH)3 |
Fe(OH)2 |
|
Mg(OH)2 |
Zn(OH)2 |
Cr(OH)3 |
|
LiOH |
NaOH |
Ba(OH)2 |
в) Виберіть рядок або діагональ, де вказано формули сульфатів:
|
Na2 S |
Na2 SO3 |
Li2 SO4 |
|
CuS |
MgSO3 |
K2 SO4 |
|
H2 SO4 |
BaSO3 |
CuSO4 |
4. Усно — дайте назви всім речовинам з попереднього завдання (а–в).
5. Закінчіть рівняння можливих хімічних реакцій (повторення хімічних власти-
востей основних класів неорганічних речовин як ключової компетенції теми).
Використання блоків завдань «Класи неорганічних речовин»
а) Оксиди:
- взаємодія калій оксиду з водою;
- взаємодія карбон(IV) оксиду з водою;
- взаємодія купрум(ІІ) оксиду із сульфатною кислотою;
- взаємодія натрій гідроксиду із сульфур(VI) оксидом;
- взаємодія магній оксиду з фосфор(V) оксидом.
б) Кислоти:
- взаємодія заліза з хлоридною кислотою;
- взаємодія срібла із сульфітною кислотою;
- взаємодія натрій оксиду з нітратною кислотою;
- взаємодія барій гідроксиду з ортофосфатною кислотою;
- взаємодія натрій силікату з хлоридною кислотою.
в) Основи:
- взаємодія калій гідроксиду із сульфур(IV) оксидом;
- взаємодія ферум(ІІІ) гідроксиду з нітратною кислотою;
- взаємодія купрум(ІІ) хлориду з натрій гідроксидом;
- термічний розклад ферум(ІІ) гідроксиду.
г) Солі:
- взаємодія калій карбонату і хлоридної кислоти;
- термічний розклад барій карбонату;
- взаємодія цинку й купрум(ІІ) сульфату;
- взаємодія ферум(ІІ) сульфату й барій гідроксиду.
IV. Підбиття підсумків уроку, оцінювання учнів, висновки
V. Домашнє завдання


про публікацію авторської розробки
Додати розробку
