Ступінь окиснення. Визначення ступеня окиснення атома елемента за хімічною формулою сполуки.
Конспект уроку
Тема: Ступінь окиснення. Визначення ступеня окиснення атома елемента за
хімічною формулою сполуки.
Мета: Ввести поняття ступеня окиснення; поглибити поняття валентності; виробити навички розрахунку ступеня окиснення в складних речовинах; виявити подібність і відмінність валентності та ступеня окиснення; розвивати вміння складати формули бінарних сполук за ступенями окиснення елементів.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця електронегативностей хімічних елементів, роздатковий матеріал.
ХІД УРОКУ
I. ОРГАНІЗАЦІЙНИЙ ЕТАП
II. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
1) Які типи зв'язків ви знаєте?
2) Який зв’язок називають ковалентним?
3) Який зв’язок називають ковалентним полярним?
4) Який зв’язок називають ковалентним неполярним?
5) Який зв’язок називають йонним?
6) Що таке електронегативність?
7) Складіть рівняння реакцій між речовинами утвореними елементами протонними числами: а) 13 і 17 ; б) 15 і 1; в) 12 і 7 ; г) 7 і 1.
8) Визначте тип хімічного зв’язку в утворених сполуках користуючись поняттям електронегативності склавши їх структурні формули.
Складаючи структурні формули ви користувались поняттям валентність.
Дати визначення поняттю валентність?
Валентністю називають число одинарних зв’язків, які атом утворює з іншими атомами в молекулі. Під числом хімічних зв’язків розуміють число спільних електронних пар. Спільні електронні пари утворюються тільки у випадку ковалентного зв’язку, тому валентність атомів можна визначити тільки в ковалентних сполуках.
IIІ. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
У йонних сполуках немає спільних пар електронів, тому для цих речовин поняття про валентність не можна використовувати. Для всіх сполук, незалежно від виду хімічних зв’язків, застосовується більш універсальне поняття — ступінь окиснення.
IV. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. ДАЄМО ПОНЯТТЯ «СТУПІНЬ ОКИСНЕННЯ».
Ступінь окиснення елемента — це умовний заряд атома в речовині, обчислений із припущенням, що вона складається з іонів. Ступінь окиснення характеризує число умовно прийнятих або умовно відданих електронів. Ступінь окиснення може бути позитивним(якщо атом віддав електрони), негативним (якщо атом прийняв електрони) або дорівнювати нулю. Він позначається арабською цифрою зі знаком «плюс» або «мінус» над символом елемента.
2. ПРАВИЛА ВИЗНАЧЕННЯ СТУПЕНЯ ОКИСНЕННЯ.
- Ступінь окиснення атомів в простій речовині дорівнює нулю.
- Атомам деяких хімічних елементів звичайно приписують сталі ступені окиснення. Наприклад, ступінь окиснення Флуору в сполуках завжди дорівнює –1; елементи І, ІІ, ІІІ групи головної підгрупи мають с.о що дорівнює № групи із знаком +.
- Ступінь окиснення Гідрогену в більшості сполук +1, і лише в сполуках з металами він дорівнює –1.
-
Ступінь окиснення Оксигену в більшості сполук –2, і лише в деяких сполуках йому приписують ступінь окиснення –1 (
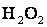 ,
, 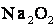 або +2 (
або +2 (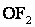 ).
).
- Ступінь окиснення атома металлу побічної підгрупи в сполуках позитивний і чисельно дорівнює його валентності.
- Сума ступенів окиснення всіх атомів у сполуці дорівнює нулю.
- Атоми багатьох хімічних елементів виявляють змінні ступені окиснення.
Користуючись наведеними правилами, визначимо ступені окиснення хімічних елементів у сполуках:
H2, LiCl, AgNO3, KH, HNO3, O2, BaCl2, Mg, Al2S3, SO2, Al, BaH2, HI, Cu2O, CO2, CO, HCl, N2, AlI3, FeSO4, Na2CO3, H2SO4, Zn(NO3), Al2(SO4)3, Ca3(PO4)2.
V. УЗАГАЛЬНЕННЯ ТА СИСТЕМАТИЗАЦІЯ ЗНАНЬ
Учні діляться на чотири команди.
Прийом «Тест-ранжування»
Учням пропонують перелік об’єктів контролю, які повинні бути розташовані в певній послідовності.
Розташуйте на дошці речовини в порядку збільшення ступеня окиснення Нітрогену:
І команда: N2O, NO2 , НNO3, N2
Розташуйте речовини в порядку збільшення ступеня окиснення Хрому:
ІІ команда: Cr2O3 , K2Cr2O7 , CrCl2 , Cr
Розташуйте речовини в порядку збільшення ступеня окиснення Хлору:
ІІІ команда: NaClO3 , Cl2O , Cl2O7, Cl2
Розташуйте речовини в порядку збільшення ступеня окиснення Мангану:
IV команда: KMnO4 , MnO2 , MnO, Mn2O5
Прийом «Вибери мене»
Виберіть формули у яких ступінь окиснення сполученого з Оксисеном елемента найнища і найвища?
CO2, SO3, Al2O3, Na2O, N2O5, Cl2O7
Прийом «Хрестики-нулики»
I команда: Обрати лінію, яка сполучає формули сполук, що мають ступінь окиснення+1.
|
SO2 |
BaO |
H2O |
|
Na2O |
CO2 |
K2O |
|
Fe2O3 |
Al2O3 |
Cu2O |
ІІ команда: Шляхом до виграшу є оксиди з ступенем окиснення елемента +4.
|
SO2 |
BaO |
CuO |
|
N2O |
SiO2 |
H2O |
|
PbO2 |
V2O5 |
CO2 |
IІІ команда: Обрати лінію, яка сполучає формули сполук, що мають ступінь окиснення+3.
|
SO2 |
BaO |
H2O |
|
Na2O |
CO2 |
K2O |
|
Fe2O3 |
Al2O3 |
Cr2O3 |
ІV команда: Шляхом до виграшу є оксиди з ступенем окиснення елемента +2.
|
SO2 |
BaO |
CuO |
|
N2O |
CaO |
H2O |
|
PbO2 |
MgO |
CO2 |
Прийом «Логічні квадрати»
Знайдіть у логічних квадратах місце таким речовинам: CaO, CO2, H2O, N2O3. Поясніть
відповідь.
|
Al2O3 |
Fe2O3 |
|
Cl2O3 |
|
|
BaO |
MgO |
|
CO |
|
|
SO2 |
MnO2 |
|
NO2 |
|
|
N2O |
K2O |
|
Cl2O |
|
Прийом «Хімічна естафета»
- На столі розкладені карточки з формули сполук по кількості учнів в команді. Учні, змінюючи один одного, беруть карточку, записують хімічну формулу на дошці і визначають ступінь окиснення елементів.
|
Fe2O3 |
Na2O |
K2O |
|
Cu2O |
Al2O3 |
CO2 |
|
SO2 |
BaO |
H2O |
|
H2SO4 |
H3PO4 |
H2SO3 |
|
NaOH |
KOH |
LiOH |
|
Ba(OH)2 |
Al(OH)3 |
Fe(OH)2 |
|
Na3PO4 |
Na2SO4 |
K2CO3 |
|
BaI2 |
MgS |
BaCl2 |
Завдання.
1) Випишіть окремо сполуки із ковалентним неполярним, ковалентним полярним та іонним зв'язком: F2, Н20, FeCl3, 02, А14С3, NH3, С02, N2, Са3Р2.
2) Визначте ступінь окиснення кожного елемента в сполуках: KCl, КМп04, К2Сг2O7
3) Визначте ступені окиснення:
а) Оксигену в сполуках: OF2, 02, 03, Н202, Н20, С02;
б) Мангану в сполуках: Мп, МпО, Мп02, К2Мп04, КМп04, Мп207.
4) Напишіть схеми будови електронної оболонки атома Хлору, що перебуває в ступені окиснення -1, 0, +1, +3, +5, +7.
5) Елемент у ступені окиснення +2 має таку саму будову електронної оболонки, як і атом Неону. Визначте елемент.
VI. ДОМАШНЄ ЗАВДАННЯ
1. Вивчити записи в зошиті.
2. Виконати завдання за умовою в зошиті.


про публікацію авторської розробки
Додати розробку
