Сучасне формулювання періодичного закону. Ізотопи (стабільні та радіоактивні). Нуклід.
УРОК ХІМІЇ 8 клас
Тема. Сучасне формулювання періодичного закону. Ізотопи (стабільні та радіоактивні). Нуклід.
Мета: навчальна: розширити знання про періодичний закон і періодичну систему хімічних елементів Д.І. Менделєєва;
ознайомити з сучасним формулюванням періодичного закону;
сформувати поняття: нуклід, ізотопи;
поглибити уявлення про хімічний елемент;
ознайомити учнів з природою радіоактивного випромінювання, його шкідливим впливом на здоров’я людини;
сформувати вміння визначати кількість протонів і нейтронів в ядрах атомів хімічних елементів;
розвиваюча: стимулювати свідоме ставлення учнів до вивчення нового матеріалу;
розвивати логічне мислення, вміння робити висновки, порівнювати та встановлювати причинно-наслідкові зв′язки;
виховна: виховувати екологічну свідомість учнів, допитливість, прагнення брати активну участь у пошуку нових знань, вміння працювати у колективі, продовжити створення гендерночутливого освітнього середовища в закладі освіти, на прикладі життя Марії Кюрі-Склодовської, вчити учнів ніколи
(незважаючи на стать) не втрачати власної гідності, бути сильними і наполегливими в освіті, у досягненні своєї мети.
Тип уроку: засвоєння нових знань, умінь, навичок.
Обладнання: періодична система Д. І. Менделєєва, презентація Power Point,
відеофрагменти.
Форми роботи: розповідь учителя, обговорення відео, презентація, робота в групах, вправа: «Асоціативний кущ».
Хід уроку
І. Організаційний момент. Створення позитивного емоційного настрою.
Добрий день!
Сьогодні на уроці я бажаю вам бути успішними, впевненими в собі. Усміхніться, і до вас прийде радісний настрій.
ІІ. Актуалізація опорних знань учнів. Робота в парах.
Напишіть пропущені слова:
1) Період- це фрагмент природного ряду елементів від лужного елементу до інертного.
2) Вертикальні стовпчики періодичної системи називають – групами.
3)Атом складається з двох основних частин: ядра і електронів.
4) Ядро має позитивний заряд.
5) Ядро складається з протонів і нейтронів.
6) Майже вся маса атома зосереджена в його ядрі.
7) Заряд ядра атома визначається числом протонів в його складі і не залежить від числа нейтронів.
8) На число протонів в ядрі вказує порядковий номер елемента.
9) Сумма чисел протонів і нейтронів відповідає атомній масі елемента.
10) Кількість електронів в атомі дорівнює порядковому номеру елемента.
11) Атом елемента з порядковим № 11 має 11 електронів, 11 протонів, 12 нейтронів.
ІІІ. Мотивація навчальної діяльності. Очікування
Відеофрагмент «Ядерний вибух».
Вправа: «Асоціативний кущ».
Питання:
- Як називається явище, що ви бачите?
- Яку асоціацію викликав у вас цей відеофрагмент?
- Яке це явище: фізичне чи хімічне? Чому?
Сьогодні ми будемо працювати творчо, щоб зробити для себе певні висновки. І ви зможете відповісти на питання.
Якій людині належать ці п’ять життєствердних уроків?
Урок 1: Навіть найбільші перешкоди не повинні завадити вам займатися улюбленою справою.
Урок 2:Діліться своїми ідеями.
Урок 3: Не дозволяйте дискримінації зупинити вас.
Урок 4: Правильно використовуйте небажану увагу.
Урок 5: Емігранти можуть бути героями не тільки у себе на батьківщині.
IV. Повідомлення теми, мети уроку
Сьогодні на уроці ви дізнаєтеся відповіді…
V. Вивчення нового матеріалу
1. Сучасне формулювання періодичного закону.
Відкриття фізичного змісту порядкового номера дало нове обґрунтування розміщення елементів в періодичній системі. З'ясувалося, що елементи розміщені не стільки за зростанням атомної маси, скільки за зростанням заряду ядер їх атомів. Отримала пояснення і гадана суперечливість в системі Д. І. Менделєєва - розміщення трьох пар елементів (Аргон і Калій, Кобальт і Нікол, Телур і Йод) не в порядку зростання їх атомних мас, а навпаки. Виявилося, що таке розміщення відповідає величині зарядів ядер атомів цих елементів. Отже, немає протиріччя.
Зазначені міркування дозволили дати нове визначення хімічного елемента.
Хімічний елемент – це сукупність атомів з однаковим зарядом ядра.
А також уточнити формулювання періодичного закону.
Властивості елементів, а також властивості й форми їхніх сполук перебувають у періодичній залежності від заряду атома елемента.
2. Ізотопи .
Кожний вид атома будь-якого елемента описується сумою протонів і нейтронів – нуклонним числом. З цієї причини видів атомів більше, ніж елементів. Кожний окремий вид атомів називається нуклідом.
Отже, нукліди – це різновиди атомів з певним числом протонів і нейтронів.
«Нуклідом» позначають будь-які атоми, які відрізняються складом ядра. Для позначення нуклідів використовують назву елемента, до якої через дефіс приєднують нуклонне число (Оксиген-16) або ![]() .
.
Якщо нукліди належать одному й тому самому хімічному елементу і мають однакову кількість протонів, але різну кількість нейтронів, то вони називаються ізотопами.
Отже, ізотопи – це нукліди одного хімічного елемента, які мають однакове протонне число.
Вперше поняття «ізотоп» ввів в 1913 році Ф. Содді.
Наприклад, природний Оксиген містить три нукліда ![]() . Тобто, в природному Оксигені є різні види атомів, які в своєму ядрі містять однакову кількість протонів 8, але різну кількість нейтронів 8,9,10. З цієї причини вони й різняться між собою атомною масою.
. Тобто, в природному Оксигені є різні види атомів, які в своєму ядрі містять однакову кількість протонів 8, але різну кількість нейтронів 8,9,10. З цієї причини вони й різняться між собою атомною масою.
Ізотопи позначаються символом хімічного елемента з двома індексами ліворуч ![]() : верхній показує масове число, тобто загальна кількість нейтронів і протонів у ядрі, а нижній – абсолютне значення заряду ядра, тобто кількість протонів.
: верхній показує масове число, тобто загальна кількість нейтронів і протонів у ядрі, а нижній – абсолютне значення заряду ядра, тобто кількість протонів.
Назви і символи ізотопів збігаються з назвами і символами відповідного хімічного елемента. Винятком є ізотопи найлегшого з елементів – Гідрогену.
Хімічний елемент – це вид атомів з однаковим зарядом ядра (протонним числом).
3. Відносна атомна маса
У природі більшість хімічних елементів існує у вигляді ізотопів. Тому відносна атома таких елементів визначається величинами відносних атомних мас кожного з нуклідів з урахуванням їх масової частки в природі.
Відносна атомна маса – це середнє значення атомних мас його ізотопів з урахуванням їх масових часток у природному елементі.
Наприклад, елемент Оксиген являє собою суміш ізотопів - нуклід ![]() 99,757%,
99,757%, ![]() 0,039%,
0,039%, ![]() 0,0204%. Для знаходження атомної маси Оксигену треба:
0,0204%. Для знаходження атомної маси Оксигену треба:
![]()
Тобто загальна атомна маса Оксигену – 16.
Саме з цієї причини атомні маси елементів є дробовими числами.
Значення відкриття ізотопів зіграло важливу роль для розвитку теорії будови атома та Періодичного закону:
1)пояснило деякі відхилення від Періодичного закону, сформульованого Менделєєвим, у послідовностях зростання атомних мас хім. елементів і їх порядкових номерів (розташування елементів Ar i K, Co i Ni, Te i I);
2)дало змогу змінити це формулювання на сучасне, в якому за основу покладено не атомну масу, а заряд ядра;
3)уточнило поняття «хімічний елемент» і «відносна атомна маса елемента» в Періодичній системі.
4. Ізотопи стабільні і радіоактивні (радіонукліди).
Ізотопи поділяються на:
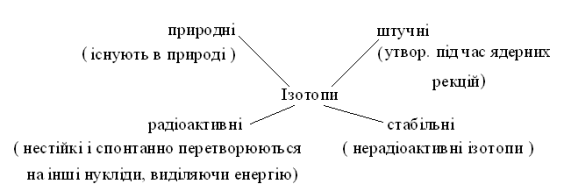
Стабільні нукліди мають усі «парні» елементи і більшість «непарних» з протонним числом < 83. Нукліди всіх елементів, розміщених у Періодичній таблиці після Ві, радіоактивні.
Одним із відкриттів, що стало доказом складності будови атома, є радіоактивність. Що ж це таке? Це явище випускання деякими елементами випромінювання, яке здатне проникати через речовини.
Вперше це явище у 1896р. виявив у сполуках Урана французький фізик А. Беккерель. Потім Марія Кюрі-Склодовська встановила, що радіоактивністю володіють і сполуки торія. В 1898 р. вона разом із своїм чоловіком, французьким фізиком П’єром Кюрі, відкрила в складі уранових руд два нових радіоактивних елемента, названих полонієм (Польща) і радій (промінь). І ці елементи були набагато сильнішим джерелом випромінювання за уран і торій. Хочеться відзначити, що Марія Кюрі-Склодовська – єдина жінка, двічі удостоєна Нобелівської премії (хімія і фізика).
Саме досліди подружжя Кюрі і Е. Резерфорда довели, що радіоактивне випромінювання під дією магнітного поля розділяється на три пучки: α-промені (позитивно заряджені і складаються із частин, маса яких рівна масі атома Гелія), β-промені (негативно заряджені і являють собою потік електронів) і γ-промені (електромагнітне випромінювання, подібне до рентгенівських променів і володіє значною проникною здатністю).
У процесі радіоактивного випромінювання атоми радіоактивних елементів здатні самочинно розпадатися, перетворюючись на атоми інших елементів.
Наприклад, ![]()
Радон є радіоактивним, і він також випромінює електрон, перетворюючись на нуклід Францію-222 і т.д.: ![]()
Такі реакції називають ядерними. Ядерні реакції – процеси радіоактивного розпаду, під час яких відбувається перетворення одних атомів на інші.
Кожен радіонуклід має свою швидкість радіоактивного розпаду, яка називається періодом напіврозпаду. Він показує, протягом якого часу розпадеться половинна початкової кількості радіонукліда. Період напіврозпаду – інтервал часу, протягом якого кількість радіоактивних атомів даного елемента зменшується вдвічі.
Однією з відкривачів в галузі радіаційної хімії є Марія Склодовська-Кюрі. Прослухаємо повідомлення про її життєвий шлях.
Повідомлення учнів і презентація «Її життя – це подвиг».
Перегляд відеофрагменту про життя й відкриття Марії Склодовської-Кюрі.
https://www.youtube.com/watch?v=DF8H6PqJ00o
VІ. Закріплення
Робота учнів з картками
Практика на прикладах.(Учні отримують аркуш із завданнями.)
Завдання 1. Знайдіть серед елементів такий, відносна атомна маса якого — 23, а число протонів — 18:

Завдання 2. Знайдіть серед елементів такий, відносна атомна маса якого — 40, а число протонів —11.

Завдання 3. Обчисліть відносну атомну масу атомів Аргону й Гелію за такими даними:
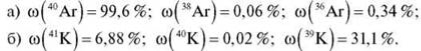
Одержаний результат пояснює аномалію розташування цих хімічних елементів у періодичній системі хімічних елементів Д. І. Менделєєва.
VІІ. Підсумок уроку
Спільне оцінювання діяльності учнів на уроці.
- Повернемося до питання, яке було на початку уроку.
-Якій людині належать ці п’ять життєствердних уроків? ( Марія Склодовська-Кюрі)
Висновок учителя
Уявіть собі дамські рукавички, які завжди носила М. Склодовська-Кюрі, щоб прикрити руки, безжалісно понівечені Радієм. А поруч, не вмовкаючи, тріскотить лічильник Гейгера. Відвідувачі Всесвітньої виставки в Брюсселі ціпеніли, коли дивилися на ці рукавички. Ще в 1958 році – через півстоліття! – вони відчували від цих рукавичок не запах тонких парфумів, а «голос» того самого Радію, якого безстрашно торкалися руки відважної жінки.
Незламну волю Марії Склодовської-Кюрі, її мужність, внесок у розвиток науки і в боротьбу за рівність (незалежно від статі) у всіх сферах життя годі переоцінити. Сподіваємося, що, надихаючись її прикладом, ми, за її словами, будемо «ненастанно розширювати рамки пізнання, неупереджено досліджувати таємниці матерії і життя (...), бути серед тих, хто, як Пастер, твердо вірить, що наука і мир переможуть неуцтво і війну.»
Розв’язування кросворду
|
|
1.Г |
|
|
|
|
|||||
|
|
2. |
Е |
|
|
|
|
|
|||
|
|
3. |
|
|
|
Н |
|
|
|||
|
4. |
|
|
|
|
Д |
|||||
|
|
5. |
|
Е |
|
|
|
|
|
||
|
6.Р |
|
|
|
|
||||||
1. Вертикальний стовпчик періодичної системи називають…(Група)
2. Перетворення речовин, при якому молекули одних речовин руйнуються і на їхньому місці утворюються молекули інших речовин з іншим атомним складом, - це...(Реакція)
3. Марія Кюрі-Склодовська із своїм чоловіком, французьким фізиком П’єром Кюрі, відкрила в складі уранових руд новий радіоактивний елемент, який отримав назву …( Полоній)
4. Різновид атомів з певним числом протонів і нейтронів,- це …(Нуклід)
5. Стабільна, негативно заряджена елементарна частинка, що входить до складу всіх атомів,-це…(Електрон)
6. Радіоактивний хімічний елемент, атомний номер 88. Відкритий у 1898 році П'єром Кюрі і Марією Склодовською-Кюрі, - це…(Радій)
Вправа «Незакінчене речення».
Пропоную учням продовжити речення: «На цьому уроці мене вразило те, що…».
VІІІ. Домашнє завдання
Опрацювати §10, виконати завдання 2-5 с.55. Додаткове завдання:підготувати повідомлення «Природна радіація», створити кросворд використовуючи вивчений на уроці матеріал.


про публікацію авторської розробки
Додати розробку
