Сульфатна кислота. Особливості взаємодії концентрованої сульфатної кислоти з металами.
Тема заняття: Сульфатна кислота. Особливості взаємодії концентрованої сульфатної кислоти з металами.
Мета заняття:
освітня: вивчити фізичні і хімічні властивості сульфатної кислоти, дати уявлення про властивості і застосування сульфатів, вивчити якісну реакцію на сульфат-іон;
розвиваюча: розвивати вміння узагальнювати і систематизувати, зіставляти і порівнювати, самостійно знаходити інформацію, опрацьовувати її, складати йонно–молекулярні рівняння реакцій на прикладі властивостей сульфатної кислоти;
виховна: виховувати бажання вчитися, формувати екологічну свідомість.
Тип заняття: формування та вдосконалення вмінь і навичок
Форми: лекція конкретизація та поглиблення знань
Методи: бесіда, розповідь, демонстраційний і лабораторний досліди, виконання вправ
Забезпечення заняття: періодична система хімічних елементів, таблиця розчинності, ряд активності металів. Хімічний посуд, реактиви.
Технічні засоби навчання: мультимедійний комплекс
Наочні посібники:
Попель П.П., Крикля Л.С. Хімія: підруч. для 10 кл. загальноосвіт.навч. закл. – К.: ВЦ «Академія», 2013.
Хомченко Г.П. «Загальна хімія» - К: Вища школа 1993 р.
Роздатковий матеріал: роздаткові картки
Хід і зміст заняття
І. Організаційна частина
- привітання;
- інформація про відсутніх;
- перевірка підготовки студентів і аудиторії до заняття;
ІІ. Актуалізація опорних знань, перевірка домашнього завдання.
- Виконання самостійної роботи з теми «Сполуки неметалів з гідрогеном і оксигеном. Солі амонію»
-
Робота біля дошки з роздатковими картками (виконують завдання 3 студенти)
- Установити відповідність:
N2O5 H2 CO3
SO2 HNO3
CO2 H2 SO4
SO3 H2 SO3
- Здійснити перетворення:
FeS2 → SO2 → SO3 → H2 SO4
- Записати рівняння гідратації оксидів із завдання 1.
- Вправа «Хімічна розминка»
- Які речовини називають кислотами?
- Як класифікують кислоти?
- Назвати формули безоксигенових кислот.
- Назвати формули оксигеновмісних кислот.
- Назвати формули одноосновних кислот.
- Назвати формули двоосновних кислот.
- Назвати формули триосновних кислот.
- Назвати формулу сильної двоосновної оксигеновмісної кислоти, утвореної Сульфуром, та вказати її назву.
ІІІ. Мотивація навчальної діяльності, значення теми для:
- майбутньої діяльності;
- вивчення інших тем і дисциплін;
- повсякденних справ.
ІV. Усвідомлення нових знань:
- Будова молекули
Розповідь викладача з використанням презентації
- Фізичні властивості сульфатної кислоти.
-
Хімічні властивості розчину сульфатної кислоти
- Сильний електроліт, у розчині практично повністю дисоціює на йони:
![]()
![]() +
+ ![]()
- Вплив сульфатної кислоти на зміну забарвлення індикаторів
Демонстраційний дослід
У три пробірки наливаю по 2 мл розбавленого розчину сульфатної кислоти і додаю по 1-2 краплі індикатора, пропоную студентам зробити висновок про зміну кольорів індикаторів у кислому середовищі.
- Реакції з металами
Розбавлена сульфатна кислота реагує з металами, які в ряду активності металів розміщені лівіше від Гідрогену.
Демонстраційний дослід: взаємодія ![]() з Zn, Mg, Fe (студенти записують на дошці рівняння реакцій, складають йонні рівняння)
з Zn, Mg, Fe (студенти записують на дошці рівняння реакцій, складають йонні рівняння)
![]()
![]()
![]()
- Реакції з основними оксидами
Сульфатна кислота реагує з основними оксидами з утворенням солей відповідних металів і води.
(Студенти записують на дошці рівняння реакцій, складають йонні рівняння)
![]()
![]()
![]()
Демонстраційний дослід: взаємодія ![]() з
з ![]()
- Реакції з лугами та нерозчинними основами
Сульфатна кислота утворює два ряди солей: кислі й середні. Які саме з них утворюються, залежить від кількісного співвідношення реагентів.
Демонстраційний дослід: взаємодія ![]() з
з ![]()
В пробірку з розбавленою сульфатною кислотою додаю 2-3 краплі фіолетового лакмусу, розчин набуває червоного забарвлення. Потім додаю краплями ![]() доти, доки вміст пробірки не набуде фіолетового забарвлення, тобто виникає нейтральне середовище, утворюється середня сіль. Якщо ж розчину не вистачає для нейтралізації усієї кислоти, то утворюється кисла сіль.
доти, доки вміст пробірки не набуде фіолетового забарвлення, тобто виникає нейтральне середовище, утворюється середня сіль. Якщо ж розчину не вистачає для нейтралізації усієї кислоти, то утворюється кисла сіль.
(Студенти записують на дошці рівняння реакцій, складають йонні рівняння)
![]()
![]()
Вправа 1
(Виконується студентами самостійно в робочих зошитах, здійснюється взаємоперевірка)
Написати рівняння реакцій сульфатної кислоти з кальцій гідроксидом, купрум (ІІ) гідроксидом, алюміній гідроксидом.
- Реакції з солями
Сульфатна кислота вступає в реакцію обміну з солями, утвореними слабшими і навіть сильними кислотами, якщо вони менш стійкі.
Демонстраційний дослід: взаємодія ![]() з
з ![]()
В пробірку поміщаю ¼ мірної ложечки кальцинованої соди і доливаю 1-2 мл розчину сульфатної кислоти. Пропоную студентам пояснити спостережуване явище і самостійно написати рівняння хімічної реакції.
Вправа 2
(Виконується студентами самостійно в робочих зошитах, здійснюється взаємоперевірка)
Написати рівняння реакцій сульфатної кислоти з калій нітратом, барій хлоридом, кальцій(ІІ) фосфатом.
-
Специфічні властивості концентрованої сульфатної кислоти
- Обвуглювання органічних речовин, що складаються з Карбону й Гідрогену.
Демонстраційний дослід: взаємодія концентрованої ![]() з цукром.
з цукром.
Цукор змішуємо з концентрованою ![]() маса чорніє, розігрівається й незабаром зі стаканчика починає виповзати пориста чорна маса:
маса чорніє, розігрівається й незабаром зі стаканчика починає виповзати пориста чорна маса:
![]()
![]()
![]()
![]() +
+ ![]()
-
Концентрована
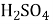 за кімнатної температури не взаємодіє з деякими металами. Це дозволяє перевозити кислоту (
за кімнатної температури не взаємодіє з деякими металами. Це дозволяє перевозити кислоту (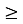 75%) у сталевих цистернах.
75%) у сталевих цистернах.
-
Взаємодія концентрованої
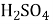 з металами.
з металами.
Унаслідок нагрівання кислота діє майже на всі метали до Ag включно (крім Pt, Au). У цьому випадку водень не виділяється, а утворюються продукти відновлення ![]() :
: ![]() ,
, ![]() а також сіль і вода. Продукти залежать від активності металу й умов реакції. Умовно можна прийняти, що сульфатна кислота відновлюється:
а також сіль і вода. Продукти залежать від активності металу й умов реакції. Умовно можна прийняти, що сульфатна кислота відновлюється:
-
з малоактивними металами – до
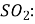
![]() +
+ ![]()
![]() +
+ ![]() +
+![]()
-
у результаті взаємодії з більш активними металами можуть виділятися
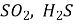 ,
, 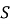 . Наприклад, взаємодія з
. Наприклад, взаємодія з 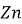 (залежно від умов – температури й концентрації):
(залежно від умов – температури й концентрації):
![]()
![]() +
+ ![]() +
+![]()
![]()
![]() +
+ ![]() +
+![]()
![]()
![]() +
+ ![]() +
+![]()
-
Сульфати
- Солі сульфатної кислоти - сульфати, гідрогенсульфати
Більшість сульфатів розчиняється у воді. При випарюванні їх розчинів часто виділяються кристалогідрати, наприклад CuSO4 • 5H2O, FeSO4•7H2О, Al2(SO4)3 •18H2 O.
Малорозчинними є солі CaSO4 і Ag2SO4,а практично нерозчинними є BaSO4 і PbSO4. Утворення осаду барій сульфату використовують як якісну реакцію на йони SO4.
Лабораторний дослід: якісна реакція на сульфат-іони
Для визначення сульфат-іонів у розчині використовую реакцію утворення практично нерозчинного білого осаду барій сульфату.
Завдання. Дослідити розчини сульфатної кислоти й натрій сульфату на наявність сульфат-іонів у розчині. Підтвердити припущення йонно-молекулярними рівняннями реакцій.
- Застосування сульфатної кислоти, сульфатів
(Повідомлення студентів)………
V. Узагальнення та систематизація знань студентів
Групова робота
Студенти об'єднуються в шість груп, завдання в групах повторюються з метою взаємоперевірки.
Завдання 1. Дописати рівняння практично здійсненних реакцій
Група 1
![]()
![]()
![]()
![]()
![]() Ag
Ag ![]()
![]()
Група 2
![]()
![]()
![]()
![]()
![]() Cu
Cu ![]()
![]()
Група 3
![]()
![]()
![]()
![]()
![]()
Завдання 2. Написати рівняння реакцій, які б ілюстрували перетворення
Група 1
![]()
![]()
Група 2
![]()
Група 3
![]()
VI. Підведення підсумків заняття
Викладач підводить підсумки заняття, оцінює роботу студентів, враховуючи їх відповіді, активність на занятті, результати взаємооцінювання.
VI І. Повідомлення домашнього завдання


про публікацію авторської розробки
Додати розробку
