Тема: Електричний струм у розчинах і розплавах електролітів.
Тема: Електричний струм у розчинах і розплавах електролітів.
Мета: пояснити природу електричного струму в розчинах і розплавах
електролітів, показати практичне застосування електролізу, спостерігати
явища, викликані електричним струмом у різних середовищах.
Тип уроку: засвоєння нових знань.
9 клас
Урок
Тема: Електричний струм у розчинах і розплавах електролітів.
Мета: пояснити природу електричного струму в розчинах і розплавах
електролітів, показати практичне застосування електролізу, спостерігати
явища, викликані електричним струмом у різних середовищах.
Тип уроку: засвоєння нових знань.
Обладнання: інтерактивна дошка, БЕН, презентація до уроку.
Хід уроку.
- Організаційний момент.
- Актуалізація опорних знань.
- Вивчення нового матеріалу.
1. Знайомимося з електролітами
Чи проводять рідини електричний струм? Розглянемо дослід. У посудину з дистильованою водою опустимо два електроди. Зберемо коло із джерела струму, ключа, лампочки та чутливого амперметра. Якщо замкнути коло, то стрілка амперметра не відхилиться. Це означає, що дистильована вода не містить вільних носіїв заряду й у колі немає струму.
У такий же спосіб можна переконатися, що суха кам’яна сіль так само є діелектриком.
А тепер «об’єднаємо» ці два діелектрики: насиплемо у посудину з водою дві-три ложки кам’яної солі. Ми побачимо, що лампочка загориться, причому в міру розчинення солі розжарення лампи збільшується.
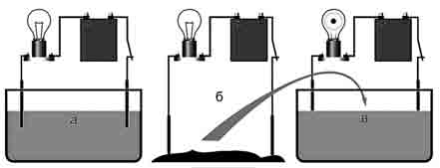
Цей дослід доводить, що підсолена вода є провідником, причому носії заряду з’являються під час розчинення солі у воді.
За допомогою подібних дослідів можна визначити, що практично усі водні розчини солей, кислот і лугів є провідниками електричного струму.
- Електролітами називаються речовини, розчини яких проводять електричний струм.
Чим же обумовлюється провідність електролітів?
2. Електричний струм в електролітах
Молекули солей, кислот і лугів утворені позитивними й негативними йонами, що утримуються силами електростатичного притягування. Наприклад, у молекулах кам’яної солі NaCl позитивно заряджений іон натрію Na+ притягується до негативного йона хлору Cl−. У водяному розчині молекули води послаблюють зв’язок між іонами:
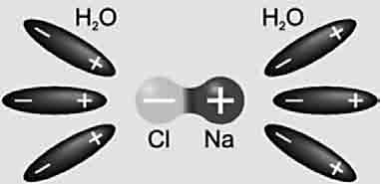
При зіткненнях, обумовлених тепловим рухом, молекула розпадається на позитивні й негативні йони, що стають носіями заряду в електроліті.
Таким чином, носіями заряду в електролітах є йони, тобто електроліти мають іонну провідність.
- Розпад молекул на йони називають електролітичною дисоціацією.
Зі збільшенням температури ступінь дисоціації зростає, а, отже, збільшується концентрація позитивно і негативно заряджених іонів.
У розчині може відбуватися також процес, що називається рекомбінацією.
- Рекомбінація — процес з’єднання йонів у нейтральні молекули.
Між процесами електролітичної дисоціації й рекомбінації йонів за незмінних умов установлюється динамічна рівновага, за якої число молекул, що розпадаються на йони за одиницю часу, дорівнює числу пар іонів, що за цей час з’єднуються в нейтральні молекули.
Іони в електролітах рухаються хаотично доти, поки в рідину не опускаються електроди. Тоді на хаотичний рух іонів накладається їхній упорядкований рух до відповідних електродів, і в рідині виникає електричний струм.
За йонної провідності проходження струму пов’язане з переносом речовини. На електродах відбувається виділення речовин, що входять до складу електролітів.
- Процес виділення речовини на електродах при проходженні електричного струму через електроліт називають електролізом.
На аноді негативно заряджені йони віддають свої зайві електрони (у хімії цей процес називається окисною реакцією), а на катоді позитивні йони одержують електрони, яких не вистачає (відновна реакція).
- Закон Фарадея
Кожний іон, що в процесі електролізу нейтралізується на електроді й виділяється на ньому у вигляді нейтрального атома, має визначену масу. Але водночас він переносить через електроліт визначений заряд. Тому і маса речовини, що виділилася, і кількість електрики, що пройшла, пропорційні числу йонів, що підходять до даного електроду.
Кількісно закон електролізу був установлений дослідним шляхом Майклом Фарадеєм у першій половині ХІХ сторіччя. Фарадей виявив, що
- маса речовини, яка виділилась на електроді при проходженні електричного струму, пропорційна заряду, що пройшов через електроліт.
m = kq.
Оскільки q=It,
де I — сила струму,
t — час проходження струму, то
m = k • I • t
Сталу k називають електрохімічним еквівалентом речовини.
Зміст цього коефіцієнта можна з’ясувати з виразу:
k = m / q
- Електрохімічний еквівалент чисельно дорівнює масі речовини в кг, що виділяється при проходженні 1 Кл електрики.
Як бачимо, електрохімічні еквіваленти неоднакові не тільки для різних речовин, але й для тієї самої речовини в різних сполуках, у яких вона має різну валентність (наприклад, CuCl і CuSO4).
Питання до учнів у ході викладу нового матеріалу
? Що являє собою електричний струм у рідинах?
? Які речовини є електролітами? Наведіть приклади.
? Чи відбувається дисоціація в розчині, у якому немає електричного струму?
? Яка умова необхідна для виникнення спрямованого руху йонів у електроліті?
Закріплення вивченого матеріалу
- Якісні питання
1. Які речовини є електролітами? Чому електроліт загалом електронейтральний?
2. Що являє собою електричний струм в електролітах?
3. Якими діями супроводжується проходження струму через електроліти?
4. Чому при проходженні струму через розчин електроліту відбувається перенос речовини, а при проходженні через металевий провідник перенос речовини не відбувається?
- Навчаємося розв’язувати задачі
- Виразіть електрохімічний еквівалент речовини через масу й заряд іона цієї речовини.
Розв’язок.
Маса m речовини, що виділилася на електроді, пов’язана з масою m0 одного йона і числом іонів N, які досягли електрода, співвідношенням
m = N m0.
Заряд q, перенесений іонами, виразимо через кількість іонів N і заряд одного йона en, де е — модуль заряду електрона, а n — число зайвих (або тих, що не вистачає) електронів в іона (його валентність). Таким чином, одержуємо
q = Ne n.
Таким чином, електрохімічний еквівалент дорівнює
k = m /q = m0 / e n
- За якої сили струму проводився електроліз розчину CuSO4,якщо за 25 хв на катоді виділилося 2 г міді? (Відповідь: 4 А.)
- У процесі електролізу з водного розчину срібної солі виділилося 500 мг срібла. Який заряд пройшов через електролітичну ванну? (Відповідь: 450 Кл.)
Що ми дізналися на уроці
- Електролітами називаються речовини, розчини яких проводять електричний струм.
- Розпад молекул на йони називають електролітичною дисоціацією.
- Рекомбінація — процес з’єднання йонів у нейтральні молекули.
- Процес виділення речовини на електродах під час проходження електричного струму через електроліт називають електролізом.
- Маса речовини, що виділилась на електроді при проходженні електричного струму, пропорційна заряду, що пройшов через електроліт.
m = k q
- Електрохімічний еквівалент чисельно дорівнює масі речовини в кг, що виділяється при проходженні 1 Кл електрики.
Домашнє завдання
1


про публікацію авторської розробки
Додати розробку
