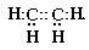Тема: Етилен і ацетилен. Молекулярні та структурні формули, фізичні властивості.
Тема: Етилен і ацетилен. Молекулярні та структурні формули, фізичні властивості.
Мета: формувати знання учнів про гомологічні ряди алкенів і алкінів на прикладі етилену і ацетилену; ознайомити учнів з природою кратного зв’язку, ізомерією за місцем положення кратного зв’язку і між класовою ізомерією; удосконалювати навички і вміння складати структурні формули і давати їм назви. Ознайомити з фізичними властивостями алкенів і алкінів;розвивати вміння спостерігати, порівнювати та робити висновки; розвивати абстрактне мислення; виховувати інтерес до предмету, працелюбність, наполегливість, вміння спостерігати, самостійність в роботі, волю до подолання труднощів.
Тип уроку: урок вивчення нового матеріалу.
Засоби та методи навчання:словесні:розповідь вчителя з елементами бесіди;наочні: таблиці «Будова алкенів і алкінів»,«Типи гібридизації»; практичні: гра «Морський бій»,лабораторний дослід.
Базові поняття:етилен,ацетилен,типи гібридизаціх.
Обладнання: Таблиці «Будова алкенів і алкінів», «Типи гібридизації», шаростержневі моделі, мультимедійна презентація до уроку.
Структура та хронометраж уроку
- Організаційний момент (2хв)
- Мотивація начально-пізнавальної діяльності (3хв)
- Актуалізація теоретичних знань (5хв)
- Виклад нового матеріалу (20хв)
- Узагальнення та закріплення нового матеріалу (10хв)
- Підсумок уроку (3хв)
- Виставлення оцінок та їх мотивація (1хв)
8. Інструктаж з домашнього завдання (1хв)
Перебіг уроку
1.Організаційний момент
(Слово вчителя)
- Привітання вчителя з учнями
- Перевірка готовності робочих місць до проведення уроку
- Перевірка присутніх
2.Мотивація начально-пізнавальної діяльності
Вуглеводні містять Гідроген і Карбон. Якщо речовина має склад СnH2n+2, то це алкан (СН4, С2Н6…)
А чи можна віднести до алкенів речовину С2Н4 і С2Н2 ? Чому? Ці речовини належать до інших гомологічних рядів – алкенів і алкінів.
Сьогодні на уроці ми познайомимося з алкенами та алканами. Навчимося складати їх формули, називати, описувати особливості будови. Розглянемо типи ізомерії характерні для ненасичених вуглеводнів.
План уроку:
- Гомологічні ряди алкенів і алкінів
- Будова молекул етилену і ацетилену
- Порівняння будови алканів, алкенів, алкінів
- Види ізомерії
- Фізичні властивості етилену і ацетилену
3.Актуалізація теоретичних знань
(Гра «Морський бій»,так чи ні)
1. Алкани відносяться до хімічно активних речовин.
2. Наявність в молекулах алканів лише одинарних (простих) зв’язків обумовлює особливості хімічних властивостей алканів.
3. Під дією метану фіолетовий розчин калій перманганату знебарвлюється.
4. Всі алкани горять, вивільняючи значну кількість теплоти, реакції горіння – це екзотермічні реакції.
5. Реакція С2Н6 + Cl2 → С2Н5Cl + НCl називається реакцією хлорування.
6. Метан та його гомологи розкладаються при сильному нагріванні без доступу кисню на водень і сажу.
7. Алкани можуть вступати в реакції приєднання галогенів.
8. Алкани застосовуються як паливо завдяки здатності вступати в реакції термічного розкладу.
9. Якщо через розчин брому, що має бурий колір, пропустити метан, то розчин знебарвиться.
10. Гомологи метану С5 ─ С11 є основою пального для автомобільних двигунів.
4.Виклад нового матеріалу
- Гомологічні ряди алкенів і алкінів
Алкени (або етиленові вуглеводні) – вуглеводні із загальною формулою СnН2n, в молекулах яких між атомами Карбону є один подвійний зв’язок.
Щоб дати назву алкенам, у назві відповідного алкану суфікс -ан замінюють на –ен.
Алкіни (або ацетиленові вуглеводні) – вуглеводні із загальною формулою СnН2n-2, в молекулах яких між атомами Карбону є один потрійний зв’язок.
Щоб дати назву алкінам, у назві відповідного алкану суфікс -ан замінюють на –ин або –ін.
Заповнити таблицю « Гомологічні ряди вуглеводнів»
(учні під керівництвом вчителя заповнюють таблицю та дають назву вуглеводням.
|
Алкани СnН2n +2 |
Алкени СnН2n |
Алкіни СnН2n ─2 |
|
СН4 метан С2Н6 етан С3 С4 С5 і т.д. |
─ С2Н4 етен (етилен) |
─ С2Н2 етин (ацетилен) |
Чому немає алкенів і алкінів з одним атомом Карбону?
- Будова молекул етилену і ацетилену
|
Ознака |
Етилен (алкен) |
Ацетилен (алкін) |
|
Особливості будови |
Має 1 подвійний зв’язок С=С |
Має 1 потрійний зв’язок -С≡ С- |
|
Молекулярна формула |
С2Н4 |
С2Н2 |
|
Електронна формула |
|
Н:С:::С:Н
|
|
Структурна формула |
Н Н |
Н – С ≡ С - Н |
- Порівняння будови алканів, алкенів, алкінів
Заповнити таблицю «Порівняння будови алканів, алкенів, алкінів» під час пояснення, використовуючи мультимедійну презентацію та власні спостереження під час виконання лабораторного досліду.
Лабораторний дослід
«Складання молекул моделей вуглеводнів»
Мета: скласти моделі молекул етану, етену, ацетилену, порівняти будову і міцність зв’язку між атомами Карбону.
- Складіть моделі молекул етану, етену, ацетилену.
- Зробіть висновок про відмінність в будові й міцності зв’язків у цих молекулах.
|
|
Алкани (етан) |
Алкени (етен) |
Алкіни (етин) |
|
Н Н | | Н – С - С – Н | | Н Н
|
Н Н |
Н – С ≡ С - Н
|
|
2.Тип гібридизації в атомах С |
SP3 |
SP2 |
SP |
|
3. Кількість гібридних хмар |
4 |
3 |
2 |
|
4.Кут між осями гібридних хмар |
109,5º (109,28) |
120 º |
180 º |
|
5.Зв’зки між атомами С |
Лише σ зв’язки |
1 σ і 1 π |
1 σ і 2 π |
|
6.Відстань між атомами С |
0,154 нм |
0,134 нм |
0,120 нм |
- Види ізомерії
- Ізомерія карбонового ланцюга
С4Н8
1 2 3 4
СН2 = СН – СН2 – СН3 1-бутен
1 2 3
СН2 = С– СН3 2-метилпропен
|
СН3
С5Н8
СН ≡ С – СН2 – СН2 – СН3 1-пентин
1 2 3 4
СН ≡ С– СН – СН3 3-метил-1-бутин
|
СН3
- Ізомерія положення кратного зв’зку
С4Н8
1 2 3 4
СН2 = СН – СН2 – СН3 1-бутен
1 2 3 4
СН3 - СН = СН – СН3 2-бутен
С4Н6
1 2 3 4
СН ≡ С – СН2 – СН3 1-бутин
1 2 3 4
СН3 - С ≡ С – СН3 2-бутин
- Міжкласова ізомерія
Алкени ізомерні циклоалканам.
С3Н6
СН2 = СН – СН3 пропен
![]() СН2
СН2
Н 2С СН2 циклопропан (циклоалкан)
Алкіни ізомерні алкодієнам.
С4Н6
1 2 3 4
СН ≡ С – СН2 – СН3 1-бутин
1 2 3 4
СН2 = СН – СН = СН2 1,3-бутадієн (дієнові вуглеводні)
- Просторова ізомерія (цис – і транс - )
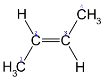
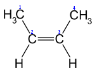
транс-2-бутен цис-2-бутен
5. Фізичні властивості етилену і ацетилену
- Гази – прозорі. Безбарвні
- Майже без запаху (С2Н4 слабкий солодкуватий запах)
- Малорозчинні у воді
- Легші за повітря : М(С2Н4) = 28 г/моль
М (С2Н2) = 26 г/моль
М(повітря) = 29 г/моль
5.Узагальнення та закріплення нового матеріалу
Бесіда
1. Чим подібні етилен і ацетилен за складом?
2. Чим відмінні етилен і ацетилен за складом?
3. Складіть молекулярні формули алкену і алкіну, що містять по п’ять атомів Карбону. Напишіть структурні формули можливих ізомерів.
4.Напишіть структурні формули речовин:
А) 2- метил-1-бутен.
Б) 3 – метил-1-пентин.
5. Визначте молекулярну формулу алкену, якщо його відносна молекулярна маса дорівнює 56.
6.Підсумок уроку
7.Виставлення оцінок та їх мотивація
8. Інструктаж з домашнього завдання
Опрацювати параграф 24,26 ;завдання:
1-12 (ст.169)– достатній рівень
1-5 (ст.181)– середній рівень
1-10 (ст.181)– високий рівень


про публікацію авторської розробки
Додати розробку