Тема: Фізичні властивості кислот. Хімічні властивості кислот: дія на індикатори, взаємодія з металами. Ряд активності металів. Реакція заміщення. Заходи безпеки під час роботи з ки
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ЦЕНТРАЛЬНОУКРАЇНСЬКИЙ ДЕРЖАВНИЙ ПЕДАГОГІЧНИЙ УНІВЕРСИТЕТ ІМЕНІ ВОЛОДИМИРА ВИННИЧЕНКА
“ЗАТВЕРДЖУЮ”
Груповий методист : Форостовська Т. О
Вчитель хімії: ________
«____»________________2022 р
КОНСПЕКТ УРОКУ
з хімії у 8 –Б класі
з теми : «Фізичні властивості кислот. Хімічні властивості кислот: дія на індикатори, взаємодія з металами. Ряд активності металів. Реакція заміщення. Заходи безпеки під час роботи з кислотами»
студентки - практикантки IV курсу
факультету математики, природничих наук та технологій
спеціальність 014 Середня освіта (Біологія та здоров’я людини)
Осікової Марини Володимирівни
Дата проведення:
“______” _________________ 2022 року
Оцінка вчителя _______ ____________
(підпис вчителя)
Урок 7. Тема: Фізичні властивості кислот. Хімічні властивості кислот: дія на індикатори, взаємодія з металами. Ряд активності металів. Реакція заміщення. Заходи безпеки під час роботи з кислотами
Лабораторні досліди:3 Взаємодія хлоридної кислоти з металами
Мета:
1) освітня – ознайомити учнів з фізичними й хімічними властивостями кислот;
2) виховна – виховувати пізнавальний інтерес до предмета;
3) розвиваюча – розвивати мислення учнів, вміння робити висновки; підвищувати творчу активність учнів; сприяти розвитку інтересу до вивчення предмета.
Тип уроку: Комбінований
Методи навчання: пояснювально-ілюстративні - бесіда, розповідь; наочні - демонстрації; практичні - виконання вправ; інтерактивні; репродуктивні, частково-пошукові, творчі, ігрові.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності кислот, основ, солей, ряд активності металів, плакат «Правила техніки безпеки в кабінеті хімії», мультимедійна презентація хімічні прилади пробірки, картки з формулами кислот спиртівка, пробіркотримач, сірники.
Реактиви: розчини сульфатної, хлоридної та лимонної кислот, індикатори: лакмус, метилоранж, фенолфталеїн, універсальний; цинк, мідь,олово
Базові поняття та терміни: кислоти, фізичні та хімічні властивості, індикатори, реакції заміщення, ряд активності металів.
Структура уроку та хронометраж:
І. Організація класу (2 хв.)
ІІ. Актуалізація опорних знань (4 хв.)
III. Мотивація навчальної діяльності, повідомлення теми та мети (3 хв.)
IV. Вивчення нового матеріалу (17 хв.)
V. Діагностика рівня засвоєних учнями знань і навичок та їх кореляція . (10хв)
VI. Закріплення нового навчального матеріалу (5 хв)
VII. Підведення підсумків уроку ( 2 хв )
VIII. Пояснювальне ознайомлення з домашнім завданням (1 хв )
Хід уроку
І. Організація класу
Привітання, перевірка присутніх.
ІІ. Актуалізація опорних знань
Самостійна робота.
1.Серед наведених речовин визнач подібні за складом:
K2O, H2SO4, KOH, ZnSO4, HNO3, P2O5, HCl, Mg(OH)2, H2SO3, Na2CO3, Na2SO4.
2.Гра «Допиши рівняння»:
а) ВаO + HNO3 =
б) Al2O3 + HCl =
в) BaO + H2SO4 =
г) K2O + HCl =
д) ZnO + HNO3 =
III. Мотивація навчальної діяльності, повідомлення теми та мети
Перед учнями ставиться проблемні питання:
- Чи можна метали розчинити у кислоті?
- Чому золоті прикраси «не бояться» води і як вони відносяться до кислот?
Учні висловлюють свої думки. Вчитель вказує на те, що всі відповіді на ці питання ми отримаємо сьогодні на уроці.
Для того щоб зрозуміти, що таке кислоти, яке місце вони посідають серед інших речовин, який взаємозв’язок існує між різними речовинами в природі, необхідно знати не лише їхній склад, але й вивчити хімічні властивості. Сьогодні на уроці ми за допомогою лабораторних дослідів разом визначимо, які хімічні властивості характерні для кислот. Після вивчення цієї теми ви будете знати:
• що таке індикатор;
• хімічні властивості кислот;
• які реакції називаються реакціями обміну та заміщення;
уміти:
• складати рівняння реакцій, що підтверджують хімічні властивості кислот;
• аналізувати, порівнювати й використовувати знання про кислоти на практиці.
IV. Вивчення нового матеріалу
Фізичні властивості кислот. Кислоти — неорганічні речовини, які за нормальних умов майже всі є рідинами (H2SO4, HNO3) або твердими речовинами (H3PO4, H2SiO3). Деякі з них — леткі (HCl, HNO3). Кислоти переважно важчі за воду, безбарвні. Леткі кислоти мають запах. Характерною їхньою властивістю є здатність розчинятися у воді (виняток — H2SiO3). Оскільки спільними в складі кислот є атоми Гідрогену, то вони зумовлюють кисле середовище їхніх розчинів. Деякі з них, як-от: хлоридна, сульфатна, нітратна — токсичні й небезпечні для життя і функціонування живих організмів. Вони роз’їдають органічні речовини, спричиняють опіки. Під час роботи з кислотами необхідно дотримуватися правил безпеки.
ЗАХОДИ БЕЗПЕКИ ПІД ЧАС РОБОТИ З КИСЛОТАМИ. Чисті неорганічні кислоти та їх концентровані розчини дуже небезпечні, бо ушкоджують слизові оболонки органів травлення, при вдиханні парів подразнюють слизові оболонки органів дихання. Потрапляючи на шкіру, спричинюють почервоніння, больові відчуття, а за великої концентрації — тяжкі опіки. Неорганічні кислоти псують одяг — на місці їх потрапляння відразу чи з часом з'являється дірка. Деякі кислоти мають різкий неприємний запах, наприклад хлоридна, сульфідна.
Кислоти зовсім не руйнують скло (винятком є плавикова, або фторидна, кислота HF), деякі пластмаси та гуму. Робота з чистими кислотами чи їх концентрованими розчинами вимагає великої уваги й акуратності. Обов'язково використовують захисний фартух із полівінілхлоридного матеріалу, гумові рукавички та окуляри.
Безпечна робота з кислотами у шкільному хімічному кабінеті досягається за рахунок того, що учні працюють з розбавленими водою кислотами, а не чистими речовинами чи їх концентрованими розчинами. Проте в будь-якому разі не можна допускати потрапляння навіть розбавлених кислот на одяг чи тіло, а особливо в очі.
Якщо раптом кислота потрапить на одяг чи на відкриту ділянку шкіри, то місце потрапляння слід ретельно промити водою, слабким розчином харчової соди.
Усі кислоти важчі за воду, через що при виготовленні їхніх розчинів кислоту ллють у воду (у жодному разі не навпаки!) невеликими порціями, помішуючи скляною паличкою.
ПАМ'ЯТАЙТЕ! У хімічному кабінеті НІКОЛИ не можна куштувати кислоти, як і будь-які інші речовини, на смак!
Хімічні властивості кислот. Вам відомо, що до складу неорганічних кислот входять атоми Гідрогену, що є спільним для цього класу сполук, і кислотні залишки.
Наявність у молекулах кислот атомів Гідрогену зумовлює подібні хімічні властивості. Дослідимо їх, використавши хімічний експеримент.
1. Зміна забарвлення індикаторів.
Перегляд відео «Дія кислот на індикатори»: https://www.youtube.com/watch?v=Ye1fCEEAh2I&ab_channel=%D0%94%D0%9E%D0%A1%D0%9B%D0%86%D0%94%D0%98%D0%97%D0%A5%D0%86%D0%9C%D0%86%D0%87%D0%94%D0%9B%D0%AF%D0%97%D0%A0%D0%A3%D0%A7%D0%9D%D0%9E%D0%93%D0%9E%D0%9D%D0%90%D0%92%D0%A7%D0%90%D0%9D%D0%9D%D0%AF
Результати спостережень запишіть до таблиці за зразком:
|
Індикатор |
Забарвлення індикатора у |
||
|
Нітратній кислоті |
Сульфатній кислоті |
Хлорид ній кислоті |
|
|
Фенолфталеїн |
|
|
|
|
Метиловий оранжевий |
|
|
|
|
Універсальний індикаторний папір |
|
|
|
2. Взаємодія кислот з металами.
Спільною властивістю кислот є їхня взаємодія з металами.
Якщо до порошку магнію долити хлоридну кислоту, відбувається характерне «закипання» суміші через інтенсивне виділення газу водню, що витіснився магнієм з кислоти. Рівняння реакції:
Mg + 2HCl = MgCl2 + H2↑.
Так само виділення водню спостерігається, якщо до гранул цинку долити розчин сульфатної кислоти (рис. 65):
Zn + H2SO4 (розб.) = ZnSO4 + H2↑.
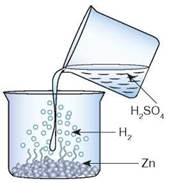
Рис. 65. Взаємодія цинку із сульфатною кислотою
• Складіть самостійно рівняння реакцій взаємодії сульфатної кислоти з магнієм і залізом.
Однак потрібно з’ясувати, чи всі метали однаково реагують з розчинами кислот. Щоб дати відповідь на це запитання, виконаємо лабораторний дослід 3.
Перегляд відео «Взаємодія хлоридної кислоти з металами»: https://www.youtube.com/watch?v=SqOEJvwHlcY&t=18s&ab_channel=%D0%AE%D0%BB%D1%96%D1%8F%D0%91%D0%B0%D1%82%D1%83%D1%80%D0%B0
Лабораторний дослід № 3
ВЗАЄМОДІЯ ХЛОРИДНОЇ КИСЛОТИ З МЕТАЛАМИ
Завдання. Дослідіть, як взаємодіє хлоридна кислота з металами. Зробіть відповідні висновки.
Обладнання та реактиви: штатив із пробірками, хлоридна кислота, метали — цинку, олова, міді.
Увага! Повторіть правила безпеки під час роботи з кислотами та дотримуйтеся їх, виконуючи досліди.
Хід роботи
Всипте приблизно однакову кількість порошку цинку, олова , міді в три пробірки. До кожної з них долийте хлоридну кислоту об’ємом по 1 мл. Спостерігайте за перебігом хімічних реакцій.
Внесіть у таблицю результати спостережень. Складіть рівняння реакцій, де це можливо, і зробіть відповідні висновки.
|
Метал |
Спостереження |
Рівняння реакції |
Висновок |
|
Zn |
|
|
|
|
Sn |
|
|
|
|
Cu |
|
|
|
Загальний висновок: ____
Отже, у пробірці з цинком інтенсивно виділяється водень, із оловом — теж відбувається реакція, проте значно повільніше. А мідь із розчином хлоридної кислоти не взаємодіє.
Це дослідження наштовхнуло вчених на думку про те, що хімічна активність металів є неоднаковою. Одні метали проявляють більшу, інші — меншу активність під час хімічних перетворень.
На основі експериментальних досліджень російський учений М. Бекетов розмістив метали у ряд активності металів.

Виявлено, що метали, розміщені в ряді активності до водню, здатні витискувати його з кислот, утворюючи просту речовину водень (виняток — нітратна кислота). П’ять металів, які розміщені після водню, з розчинами кислот не реагують. Кожний наступний метал у ряді є менш хімічно активний, ніж попередній. Самі ж метали заміщають атоми Гідрогену в кислоті. Такий тип реакцій називають реакціями заміщення.
Реакції заміщення — реакції, що відбуваються між простою та складною речовинами, унаслідок чого атоми простої речовини заміщають атоми в складній.
Крім водню, під час реакції утворюється сіль відповідного металу.
• Наведіть самостійно приклади реакцій заміщення та складіть їхні рівняння.
V. Діагностика рівня засвоєних учнями знань і навичок та їх кореляція .
1. Поясніть, як дослідити зміну забарвлення індикаторів у кислому середовищі.
2. Охарактеризуйте загальні фізичні властивості кислот.
3. Виберіть з переліку схем хімічних реакцій ті, які відповідають реакціям заміщення:
а) Аl + НСl → АlСl3 + Н2↑;
б) Mg + H2SO4 → MgSO4 + H2↑;
в) Fe + H2SO4 → FeSO4 + H2↑;
г) WO3 + H2 → W + H2O;
д) Al2O3 + HCl → AlCl3 + H2O;
е) CuO + H2 → Cu + H2O;
ж) Al + Fe2O3 → AI2O3 + Fe.
Перетворіть схеми реакцій заміщення на хімічні рівняння.
VI. Закріплення нового навчального матеріалу
Виконайте завдання:
1.Зазначте рядок, утворений двома формулами кислот й однією формулою оксиду.
А) HNO3, H2SiO3, HCl
Б) H2SO4, H2S, H2CO3
В) HNO3, HClO3, H2SO3
Г) H3PO4, SO3, HNO3
2. Зазначте формули тих речовин, які витісняють водень із кислот: Hg, Cl2, Mn, Pb, Hg, C, Cd, Pt. Запишіть відповідні рівняння хімічних реакцій, якщо в утворених складних речовинах атоми, що заміщують Гідроген у кислотах, двовалентні.
3.Зазначте тип хімічної реакції, що відбувається за поданою схемою.
Co + НСl → СоСl2 + Н2
А) сполучення
Б) обміну
В) заміщення
Г) розкладу
4. Виберіть зайве в кожному з переліків:
а) Mg, Cu, Fe;
б) Zn, Cu, Hg.
5. Установіть відповідність між схемою рівняння реакції і типом реакції.
|
Схема рівняння реакції |
Тип реакції |
||
|
1 |
H2 + О2 → H2О |
А |
заміщення |
|
2 |
HgО → Hg + О2 |
Б |
сполучення |
|
3 |
Fe + НСl → FeCl2 + H2 |
В |
розкладу |
|
|
Г |
нейтралізації |
|
VII. Підведення підсумків уроку
Бесіда:
- Що ми сьогодні вивчили на уроці?
- Що нового ви дізналися про кислоти?
- Яких правил ТБ слід дотримуватися при роботі з кислотами?
VIII. Пояснювальне ознайомлення з домашнім завданням
Опрацювати §29.
*Виконати домашній експеримент «Дія на сік буряка лимонного соку, розчину харчової соди, мильного розчину»


про публікацію авторської розробки
Додати розробку
