ТЕМА. Оксисен як хімічний елемент. Кисень як проста речовина .Добування кисню в лабораторії. Фізичні властивості кисню.
Відділ освіти Жашківської райдержадміністрації
Загальноосвітня школа І-ІІступенів с. Леміщиха
Урок хімії в 7 класі

Учитель Бондаренко
Галина Володимирівна
ТЕМА. Оксисен як хімічний елемент. Кисень як проста
речовина .Добування кисню в лабораторії. Фізичні
властивості кисню.
МЕТА: ознайомити учнів з хімічними елементами, найпоширенішим елементом на Землі – Оксигеном .Вивчити склад молекул простої речовини кисню, її фізичні властивості, способи лабораторного добування і збирання. Дати перші уявлення про речовини, здатні прискорювати хімічні реакції, розвивати вміння складати хімічні рівняння. Виховувати пізнавальну зацікавленість до предмета. На базі знань з природознавства поглибити знання про фізіологічну дію кисню.
ТИП УРОКУ: засвоєння і набуття нових знань.
МЕТОДИ УРОКУ: розповідь з елементами бесіди, демонстрація.
ОСНОВНІ ПОНЯТТЯ: Оксиген - хімічний елемент, кисень – проста речовина , реакція розкладу, каталізатор.
МІЖПРЕДМЕТНІ ЗВ’ЯЗКИ : біологія – значення кисню для живих організмів, застосування кисню людиною ; поняття ферментів, як біологічних каталізаторів.
ОБЛАДНАННЯ: таблиці «Поширення хімічних елементів», «План характеристики елемента і простої речовини».Прилади для добування газів, вата, дерев’яна скіпка. Реактиви: калій перманганат, гідроген пероксид, манган(IV)оксид.
ХІД УРОКУ
І. Організація класу.
 ІІ. Актуалізація опорних знань.
ІІ. Актуалізація опорних знань.
-
 Біля дошки розв’язати домашню задачу
Біля дошки розв’язати домашню задачу
 Дано: Розв’язування:
Дано: Розв’язування:
SO3
Mr(SO3)=32+16∙3=80 ; М (SO3)=80г/моль
W(S)-?W(О)-? М(S)=32г/моль ; М(О)= 16 г/моль.
М(S) 32г/моль
 W= = =0,4. ( 40% )
W= = =0,4. ( 40% )
M(SO3) 80г/моль
 = М(О)3 = 16 г/моль 3 =
= М(О)3 = 16 г/моль 3 =
 W(О) М(SО3) 80г/моль 0,6 ( 60% )
W(О) М(SО3) 80г/моль 0,6 ( 60% )
Відповідь:W(S)=40% ; W(O)=60%
На попередньому уроці ми з вами говорили про «Прості речовини». Порівнювали їхні загальні фізичні властивості . Давайте пригадаємо :
1. Які найважливіші фізичні властивості простих речовин?
- На які групи за фізичними властивостями поділяють прості речовини. (Ме і неМе)
- Навести приклади відомих вам металів (Au,Ag,Al,W,Cu,Fe)
- Навести приклади відомих вам неметалів.(P,S,N2,,O2,,H2С)
- Які фізичні властивості металів?
- Які фізичні властивості неметалів?
ІІІ. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
Тема «Прості речовини» є візитною карткою до вивчення складу і властивостей великого царства складних речовин. Прості речовини мають велике практичне значення в житті людини . Із речовин – неметалів особливе місце займає кисень. Сьогодні ми з вами і ознайомимося з хімічним елементом Оксигеном і простою речовиною киснем. ТЕМА УРОКУ: «Оксиген як хімічний елемент. Кисень як проста речовина. Добування кисню в лабораторії. Фізичні властивості кисню».
МЕТА УРОКУ: познайомитись з хімічним елементом, найпоширенішим на Землі – Оксигеном. Вивчити склад молекули простої речовини кисню, познайомитися з фізичними властивостями, вивчити способи лабораторного добування і збирання кисню, показати роль спеціальних речовин для прискорення реакції, розвивати вміння складати хімічні рівняння.
ІV . ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Ми будемо розглядати в такій послідовності:
- Загальна характеристика.
- Історична довідка (Відкриття кисню)
- Поширення в природі.
- Фізіологічна дія кисню.
- Добування кисню в лабораторії (реакція розкладу)
- Фізичні властивості.
1.Загальна характеристика
І так перед нами стоїть завдання розмежувати два поняття «хімічний елемент» і «проста речовина». Для цього використаємо таблицю «План характеристики елемента і простої речовини». Дивлячись на неї ,що ми можемо сказати.(Біля дошки два учні)
1.ХІМІЧНИЙ ЕЛЕМЕНТ 2. ПРОСТА РЕЧОВИНА
Хімічний символ Оксисену –О Хімічна формула простої речовини -
О2.
Відносна атомна маса – 16 Відносна молекулярна маса - 32
Валентність – два Молярна маса – 32 г/моль
До складу води, піску, глини, Є в повітрі, природних водах.
гірських порід, мінералів.
(Зробити аналіз написаного : діти переписують у зошит)
Згідно цього плану характеристики простої речовини кисню ми вже знаємо, сьогодні розглянемо ще декілька пунктів, а інші – на слідуючих уроках.
2. Історична довідка (відкриття кисню).
Світовий пріоритет відкриття кисню належить Китаю. Китайський вчений VIIIст. Мао – Хао встановив наявність у складі повітря двох газів, один з яких мав властивість підтримувати дихання і горіння.
В Європі кисень відкрили майже через 1000 років одночасно два видатних хіміка другої половини XVIII ст. – швед Карл Шеєле (1771) та англієць Джозеф Прістлі (1774). Однак К.Шеєле опублікував своє відкриття пізніше, ніж Дж. Прістлі. На одному з майданів міста Лідса вдячні англійці встановили бронзову скульптуру свого видатного співвітчизника.
І все ж таки головні особи в історії відкриття кисню не К. Шеєле і не Дж. Прістлі. Вони справді відкрили новий газ – кисень, але до кінця своїх днів залишалися ревними захисниками помилкової теорії флогістону.
За уявленнями хіміків XVIII ст. флогістон – це невагома речовина – “вогняна матерія”, яка нібито міститься в усіх речовинах, здатних горіти, і яка під час горіння звітрюється, зникає.
В історії відкриття кисню особливе значення мають праці французького вченого Антуана Лавуазьє. У 1775 р. він встановив, що кисень – складова повітря, а Оксиген входить до складу багатьох кислот та інших речовин. Саме А. Лавуазьє дослідив кисень і створив кисневу теорію горіння, яка прийшла на зміну теорії флогістону. За період, що минув з того часу (понад 200 років), киснева теорія горіння не тільки не була спростована, а й дістала ще безліч підтверджень своєї правильності.
3.Поширення в природі.
Оксиген – найпоширеніший хімічний елемент на Землі. Масова частка його в оболонці Землі (в атмосфері, гідросфері, літосфері) становить близько 52%. У зв’язаному стані, тобто як хімічний елемент, Оксиген входить до складу води, піску, глини, гірських порід і мінералів. Він є у складі всіх речовин, з яких побудовані живі організми. Зокрема в організмі людини на вміст Оксигену припадає майже 65%.
У вільному стані, тобто як проста речовина, кисень О2 є у повітрі. Масова частка його – 23%, об’ємна – 21%. Кисень міститься також у природних водах. Біохімічне очищення річкової і морської води відбувається за допомогою розчинного у воді кисню.
У природі кисень відіграє особливу роль. Він виступає одночасно і як будівельник, і як руйнівник. Окиснюючи органічні речовини, кисень підтримує дихання, отже, й життя. Енергія, що при цьому вивільнюється, забезпечує життєдіяльність організмів. Проте, за участю кисню в природі постійно відбуваються й руйнівні процеси: іржавіння металів, тління й горіння речовин, гниття рослинних і тваринних решток.
4. Фізіологічна дія кисню.
Атмосферний кисень є життєво важливим для всіх організмів (за винятком анаеробів). Він бере участь у процесі дихання. Крізь легені кисень потрапляє у кров, розноситься нею по всьому організму і в клітинах забезпечує перебіг реакцій окиснення. Вони відбуваються з вивільненням енергії, за рахунок якої підтримується стала температура тіла у теплокровних, і виконується робота: пересування, робота м’язів та інші життєві процеси. Реакції окиснення відбуваються і в рослинах, які також поглинають кисень під час дихання.
5.Добування кисню в лабораторії (реакція розкладу)
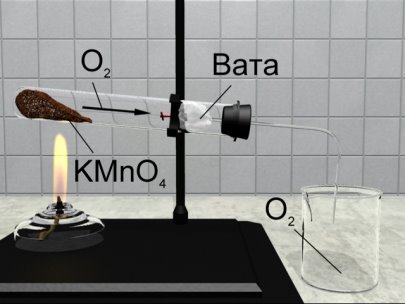
У лабораторних умовах кисень добувають розкладанням деяких оксигеновмісних речовин. Так, якщо в пробірці нагрівати калій перманганат KMnO4, то під впливом нагрівання відбувається розкладання калій перманганату на три нові речовини: калій манганат K2MnO4, манган(ІV) оксид MnO2 і кисень O2. Такі реакції належать до реакцій розкладу.
Хімічні реакції, під час яких з однієї складної речовини утворюються дві або більше нових речовин (простих чи складних), називаються реакціями розкладу.
Розкладання перманганату калію KMnO4 під час нагрівання можна виразити таким хімічним рівнянням:
2 KMnO4 = К2МnО4 + MnO2 + O2
Довести, що в пробірці кисень, а не повітря, можна за допомогою тліючої скіпки. Вона яскраво спалахує при внесенні в атмосферу кисню.
6. Фізичні властивості.
За стандартних умов кисень є безбарвним газом без смаку і запаху, мало розчинний у воді: у 100 об’ємах води при 20°С розчиняється близько 3 об’ємів кисню. Густина кисню — 1,43 г/л.
При температурі -183°С переходить у рідкий стан, при -219°С – в сині кристали.
Каталізатори
 Hе всі оксигеновмісні речовини під час нагрівання швидко розкладаються з виділенням кисню. Щоб прискорити реакцію, використовують спеціальні речовини. Наприклад, манган(ІV) оксид MnO2 прискорює розкладання гідроген пероксиду H2O2:
Hе всі оксигеновмісні речовини під час нагрівання швидко розкладаються з виділенням кисню. Щоб прискорити реакцію, використовують спеціальні речовини. Наприклад, манган(ІV) оксид MnO2 прискорює розкладання гідроген пероксиду H2O2:
2 Н2О2 = 2 Н2О + О2
Магнан(IV) оксид має властивість прискорювати розкладання деяких речовин. Він сам при цьому не витрачається і до складу продуктів реакції не входить. Такі речовини називають каталізаторами.
Каталізатори – це речовини, які змінюють швидкість хімічної реакції, але не входять до складу її продуктів.
Каталізатори широко застосовують в промисловості. Вони дають змогу підвищувати продуктивність хімічних процесів, економніше вести виробництво.
Фізичні властивості
За стандартних умов кисень є безбарвним газом без смаку і запаху, мало розчинний у воді: у 100 об’ємах води при 20°С розчиняється близько 3 об’ємів кисню. Густина кисню — 1,43 г/л.
При температурі -183°С переходить у рідкий стан, при -219°С – в сині кристали.
Висновки
Оксиген – найпоширеніший елемент на Землі. Він міститься в атмосфері, літосфері, гідросфері та живих організмах.
Оксиген утворює двохатомні молекули кисню О2 – простої речовини.
Кисень – життєво важлива речовина. За стандартних умов він являє собою газ без кольору, без запаху і смаку, мало розчинний у воді, трохи важчий за повітря.
У лабораторних умовах кисень добувають з оксигеновмісних речовин (наприклад KMnO4, H2O2) за допомогою реакції розкладу.
V. Узагальнення і систематизація знань учнів.
Уважно подивились на дошку , все там правильно? ( розставити коефіцієнти)
1 До якого типу належать ці реакції?
2. Що таке реакція розкладу?
3. Як називають речовини, що підвищують продуктивність хімічних процесів?
4, Що називають каталізаторами?
5. Хто і коли вперше відкрив кисень?
VІ. Підсумок уроку.
VІІ. Домашнє завдання
Буринська § 19 вивчити ст.. 55 № 1-6, задача.
Додаткові завдання
Яка маса відповідає магній оксиду кількістю речовини 6 моль?
|
Дано: ν(MgO) = 6 моль |
Розв’язування: Відомо, що m = M · M(MgO) = 24 + 16 = 40 г/моль m(MgO) = 40 г/моль · 6 моль = 240 г |
|
m(MgO) - ? |
Відповідь: Кількості речовини магній оксиду MgO 6 моль відповідає його маса, що дорівнює 240 г.
1


про публікацію авторської розробки
Додати розробку
