Тренувальні вправи з органічної хімії для підготовки до ЗНО
Органічна хімія
1 Назвіть речовину, формула якої
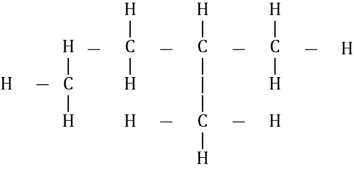
а) 2 – метилбутен
б) 2 – метилбутан
в) 3 – метилбутан
2 Назвіть речовину, формула якої

а) 2- метил- 3 - хлорбутан
б) 2 – хлор - 3 - метилбутан
в) 2 – метилбутан
3 Назвіть речовину, формула якої
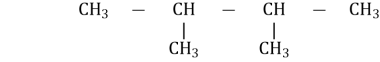
а) 3 - метилгексан
б) 2 - метилбутан
в) 2, 3 – диметилбутан
4 Вкажіть назву речовини
СН3 – С ![]() СН
СН
а) пропан
б) пропен
в) пропін
5 Назвіть речовину, формула якої
СН3 – СН2 – СН2 – СН2 – СН3
а) пентен
б) пентан
в) пентин
6. Вкажіть формулу етиленового вуглеводню:
а) СН3 – СН2 – СН = СН2
б) СН4
в) СН3 – СН2 - СН3
7 Вкажіть формулу ацетиленового вуглеводню
а) СН2 = СН – СН3
б) СН3 – С ![]() С – СН3
С – СН3
в) С2Н6
8 Вкажіть формулу етиленового вуглеводню
а) СН3 – СН2 – СН2 – СН2 – СН3
б) СН2 = СH – СН3
в) СН3 – СН3
9 Складіть формулу насиченого вуглеводню, молекула якого містить 7 атомів Карбону:
а) С7 Н14 б) С7Н12 в) С7Н16
10 Складіть формулу насиченого вуглеводню, молекула якого містить 9 атомів Карбону:
а) С9Н20 б) С9Н18 в) С9Н16
11 Складіть формулу етилового вуглеводню, молекула якого містить 5 атомів Карбону:
а) С5Н12 б) С5Н10 в) С5Н8
12 Серед наведених формул вкажіть формулу бутену – 1:
а) СН3 – СН2 – СН2 – СН3
б) СН3 – СН = СН – СН3
в) СН2 = СН – СН2 –СН3
13 Серед наведених формул вкажіть формулу пентану:
а) СН3– (СН2)3 – СН3
б) СН3 – СН2 – СН2 – СН3
в) СН3 – СН = СН2
14 Серед наведених формул вкажіть формулу пропену:
а) СН3–СН2– СН3; б) СН2= СН–СН3; в) СН≡С–СН3.
15. Серед наведених формул вкажіть формулу 2-метилпропену:
а) СН3
│
СН2–СН2–СН3
б) СН3
│
СН=СН
│
СН3
в) СН2=С–СН3
│
СН3
16. Вказати формулу пентану:
а) С5Н10; б) С5Н12; в) С6Н12.
17. Вказати формулу бутану:
а) С5Н10; б) С4Н8; в) С4Н10.
18. Вказати формулу пентену:
а) С5Н10; б) С6Н10; в) С5Н12.
19. Вказати формулу гептану:
а) С6Н14; б) С7Н14; в) С7Н16.
20. Вказати формулу пентину:
а) С5Н8; б) С5Н10; в) С5Н12.
21. Вкажіть назву речовини, структурна формула якої
СН3 –СН – СН3
│
СН3
а) 2-метилпропан
б) 2-йодопропан
в) 2-хлорпропан.
22. Вкажіть назву речовини, структурна формула якої
СН3 –СН – СН3
│
Сl
а) 2-метилпропан
б) 2-йодопропан
в) 2-хлорпропан.
23. Вкажіть назву речовин, структурна формула якої
СН3 –СН – СН3
│
Вr
а) 2-метилпропан
б) 2-хлорпропан
в) 2-бромпропан.
24. Вкажіть загальну формулу насиченого вуглеводню:
а) Сn Н2n+2 б) Сn Н2n в) Сn Н2n-2.
25. Вкажіть формулу сполуки, яка відповідає загальній формулі Сn Н2n+2:
а) С2 Н6 б) С2 Н4 в) С2 Н2.
26. Вкажіть формулу сполуки, яка відповідає загальній формулі Сn Н2n
а) С2 Н6 б) С2 Н4 в) С2 Н2.
27. Який тип хімічного зв’язку в молекулі ацетилену:
а) подвійний; б) ординарний; в) потрійний?
28. Який тип зв’язку в молекулі етилену:
а) подвійний; б) потрійний; в) ординарний?
29. До якого класу сполук належить 2-метилбутан:
а) насичених вуглеводнів; б) галогенопохідних;
в) ароматичних вуглеводнів?
30. До якого класу сполук належать 2-метилбутен-1:
а) насичених вуглеводнів; б) ненасичених вуглеводнів;
в) ароматичних вуглеводнів?
31. Напишіть рівняння реакцій за наведеними схемами. Яке з них відображає процес гідратації етилену?
а) С2 Н4 + Н2О → б) С2 Н4 + Н2 →
32. Напишіть рівняння реакцій за наведеними схемами. Яке з них відображає процес гідрогенізації
а) СН3-СН3 → СН2 =СН2 + ? б) СН2=СН2 + ? → СН3 –СН3 ?
33. Напишіть рівняння реакцій за наведеними схемами. Продуктом якої із них може бути хлоретан ?
а) С2 Н6 + Сl2 → б) С2 Н2 + Сl2 →
34. За наведеними схемами напишіть рівняння реакцій. Продуктом якої з них є дихлоретан?
а) С2 Н4 + НСl → б) С2 Н4 + Сl2 →
35. Напишіть рівняння реакцій за наведеними схемами. Внаслідок якої з них утворюється етиловий спирт?
а) СН2 =СН2 + Н2О → б) СН2 =СН–СН2 + Н2О →
36. Напишіть рівняння реакцій за наведеними схемами. Внаслідок якої з них утворюється оцтовий альдегід?
а) СН≡СН+Н2О → б) СН2= СН2+Н2О →
37. Який об’єм метану утвориться при взаємодії карбон(ІІ) оксиду об’ємом 5,6л з воднем об’ємом 8,4 л (н.у.)?
1) 2,8 л; 2) 5,6 л; 3) 11,2 л.
38. Обчисліть об’єм вуглекислого газу (н.у.) та масу води, які утворюються при згорянні метану об’ємом 40 м3?
1) 60 м3 СО2; 8772,8 г Н2О ;
2) 40м3 СО2; 64285,7 г Н2О;
3) 45м3 СО2; 7560,8 г Н2О.
39. Який об’єм повітря витрачається на спалювання 100м3 метану?
1) 1000 м3; 2) 952,4 м3; 3) 1500 м3.
40. Який об’єм повітря (н.у.) необхідний для спалювання 3 моль метану?
1) 640 л; 2) 672 л; 3) 896 л.
41. Який об’єм повітря необхідний для повного спалювання 10л пропану (н.у.)?
1) 238 л; 2) 260 л; 3) 250 л.
42. Який об’єм етилену, повинен прореагувати з воднем, щоб утворилося 3 г етану (н.у.) ?
1) 3,36 л; 2) 2,24 л; 3) 4,48 л.
43. Який об’єм етилену виміряного за н.у., можна добути внаслідок дегідратації 0,5 моль етанолу?
1) 11,2 л; 2) 22,4 л; 3) 5,6 л.
44. Яка маса брому може приєднатися до 2,24 л етену (н.у.) ?
1) 24 г; 2) 16 г; 3) 8 г ?
45. Скільки грамів брому може приєднатися до 3,36 л етилену (н.у.) ?
1) 24 г; 2) 16 г; 3) 32 г ?
46. Який об’єм хлору (н.у.) може приєднатися до 11,2 л етену ?
1)33,6 л; 2) 22,4 л; 3) 11,2 л.
47. В результаті гідрування етену одержали 6 г етану.
Який об’єм водню вступив в реакцію?
1) 11,2 л; 2) 4,48 л; 3) 3,36 л.
48. Розрахуйте об’єм, який займають за н.у. 14 г етену ?
1) 11,2 л; 2) 4,48 л; 3) 8,96 л.
49.Який об’єм водню піде на перетворення 2,24 л етилену в етан (н.у.) ?
1) 2,24 л; 2) 1,12 л; 3) 3,36 л.
50. У результаті гідруванні пропену добули пропан кількістю речовини 0,6 моль. Яка маса водню прореагувала?
1) 1,2 г; 2) 1,4 г; 3) 1,0 г.
51. Скільки молекул міститься в етені масою 14 г ?
1) 6,02 · 1023; 2) 3,01 · 1023; 3) 12,04 · 1023.
52. В якому об’ємі кисню згорить ацетилен кількістю речовини 6 моль?
1) 112 л; 2) 336 л; 3) 5 л.
53. Сполука має в два рази більше атомів Гідрогену ніж Карбону. Густина її за воднем 28. Визначити формулу сполуки.
1) С4Н8; 2) С4Н10; 3) С5Н8.
54. Масова частка Карбону в молекулі вуглеводню дорівнює 85,7%. Густина за повітрям 1,45. Визначити молекулярну формулу сполуки.
1) С3Н8; 2) С3Н6; 3) С4Н8.
55. Вивести формулу органічної речовини, якщо відомі масові частки елементів, які складають цю молекулу: W(C) = 51,89%, W(H) =9,73%,
W(Cl) = 38,38%. Відносна густина пари цієї речовини за повітрям дорівнює 3,19.
1) С4Н8Сl2; 2) С4Н9Сl; 3) С4Н10Сl.
56. Вивести формулу органічної речовини, якщо відомі масові частки елементів, які складають цю молекулу: W(C) = 92,3%, W(H) =7,7%. Відносна густина пари цієї речовини за воднем дорівнює 13.
1) С2Н4; 2) С2Н6; 3) С2Н2.
57. Вивести формулу органічної речовини, якщо відомі масові частки елементів, які складають цю молекулу: W(C) = 85,71%, W(H) =14.29%. Відносна густина цієї речовини за вуглекислим газом дорівнює 1,91.
1) С5Н8; 2) С5Н10; 3) С5Н12.
58. Вивести формулу органічної речовини, якщо відомі масові частки елементів, які складають цю молекулу: W(C) = 92,3%, W(H) =7,7%. Відносна густина пари цієї речовини за воднем дорівнює 39.
1) С5Н12; 2) С6Н6; 3) С6Н8.
59. Вивести формулу органічної речовини, якщо відомі масові частки елементів, які складають цю молекулу: W(Cl) = 92,21%, а все інше становить Карбон. W(H) =7,7%. Відносна густина пари цієї речовини за вуглекислим газом дорівнює 3.5.
1) ССl4; 2) СНСl3; 3) СН2Сl2.
60. Як здійснити такі перетворення:
етанол → етен → етан → брометан → диброметан ?
Написати рівняння реакцій, користуючись при цьому структурними формулами.
61. Як добути хлоретан двома різними способами? Зазначити умови реакцій, написати рівняння реакцій.
62. Як здійснити такі перетворення:
С2.Н6 → С2Н4 → С2Н5Сl
↓
С2Н4Сl2
Користуючись структурними формулами, написати рівняння реакцій.
63. Як здійснити такі перетворення:
С3Н6Вr2 → С3Н8 → С3Н7Вr → С6Н14 → С6Н12Вr2 ?
Написати рівняння реакцій, користуючись при цьому структурними формулами, назвати речовини.
64. З якими речовинами реагуватиме етанол:
а)бромом; б)йодоводнем; в )воднем; г) їдким натром?
Написати рівняння можливих реакцій.
65. Як здійснити такі перетворення:
С2Н5ОNа ← С2Н5ОН → С2Н4 ?
↓
С2Н5Сl
За допомогою структурних формул речовин написати рівняння реакцій назвати речовини.
66. Як добути етиловий спирт, маючи: а) етен; б) бромистий етил ? Написати рівняння реакцій.
67. Як гідратацією етилену добути етиловий спирт ? За допомогою структурних формул написати рівняння реакції.
68. Який об’єм етену (н.у.) витрачається на реакцію з 5,4 г води під час добування етанолу ?
1) 5,6 л; 2) 6,72 л; 3) 11,2 л.
69. Як здійснити такі перетворення:
С2Н4 → С2Н5Сl → С2Н5ОН → С2Н4 → СО2 ?
За допомогою структурних формул написати рівняння реакцій.
70.Скільки кілограмів 96%-ного етилового спирту можна добути з 400 м3 етилену?
1) 856 кг; 2) 865 кг; 3) 876 кг.
71. У лабораторії з 129 г хлоретану добули 85 г етанолу. Скільки це становить процентів від теоретично можливого виходу?
1) 94,2%; 2) 98,2%; 3) 92,4%.
72. За практичне заняття в кожній спиртівці згоряє по 10 г етилового спирту. Який об’єм кисню витрачається на горіння, якщо в класі 20 спиртівок?
1) 192 л; 2) 292 л; 3) 289 л.
73. Скільки грамів етанолу може прореагувати з 5 моль натрію?
1) 250 кг; 2) 248 кг; 3) 230 кг.
74. Який об’єм водню можна добути внаслідок взаємодії 4,6 г натрію з 62,5 мл 95,5%-ного етилового спирту, густина якого 0,8 ? Визначити масову частку сполук, що утворилися в розчині.
1) 2,24 л Н2; 2) 3,36 л Н2; 3) 4,48 л Н2;
9,2% NаОН 8,8% NаОН 9,5% NаОН
≈9% С2Н5ОNа ≈8% С2Н5ОNа ≈10% С2Н5ОNа.
75. Який об’єм кисню (н.у.) витрачається для спалювання 1 моль метанолу?
(1) 33,6 л; (2) 44, л; (3) 11,2 л.
76. З якими із зазначених речовин реагуватиме оцтова кислота:
а) фенол,б) етиловий спирт, в) сода, г)хлор, д) формальдегід?
Напишіть рівняння можливих реакцій. Зазначте їх умови.
77. Як взаємодіє оцтова кислота: а) з металом; б) з оксидом металу; в) з лугом; г) із сіллю; д) із спиртом?
Напишіть рівняння реакцій.
78. Закінчити рівняння таких реакцій:
а) СН3-СООН + Са → б) СН3-СООН + Nа2О →
в) СН3СООН + КОН → г) СН3-СООН + НОСН3 →
д) СН3-СООН + Nа2СО3 →
79. Написати в молекулярній та йонній формах рівняння реакцій взаємодії оцтової кислоти:
а) з кальцій карбонатом; б) з амоніаком; в) з магнієм.
80. Написати в молекулярній та йонній формах рівняння реакцій взаємодії оцтової кислоти: а) з натрієм; б) із содою.
81. Як здійснити такі перетворення:
С2Н5ОН → СН3СОН → СН3СООН ?
Написати рівняння реакцій, зазначити їх умови.
82. Як здійснити такі перетворення:
С → СаС2 → С2Н2 →СН3СОН → СН3СООН ?
Написати рівняння реакцій, зазначити їх умови.
83. Як здійснити такі перетворення:
С2Н4 → С2Н2 →СН3СОН → СН3СООН ?
Написати рівняння реакцій, зазначити їх умови.
84.Обчисліть масу оцтової кислоти, витраченої на реакцію з розчином натрій гідроксиду масою 120 г з масовою часткою лугу 25%.
1) 54 г; 2) 45 г; 3) 65 г.
85. Яку масу магнію і розчину оцтової кислоти з масовою часткою 0,08 треба взяти для добування водню об’ємом 2,24 л (н.у)?
1) 3,4 г Мg; 2) 2,4 г Мg; 3) 6,5 г Мg;
70 г р-ну СН3СООН; 75 г р-ну СН3СООН; 78 г р-ну СН3СООН.
86. Який об’єм розчину метанолу з масовою часткою спирту 90% і густиною 0,8 г/см3 необхідно взяти для реакції з оцтовою кислотою кількістю речовини 2 моль?
1) 88,9 л; 2) 84,6 л; 3) 98,4 л.
87. Як з трипальмітину гідролізом добути мило, застосовуючи соду? Написати рівняння реакцій утворення мила за цим способом.
88. Як відбувається омилення тристеарату і триолеїнату розчином їдкого натру? Написати рівняння реакцій.
89. Як добути тригліцериди таких кислот: а) стеаринової; б) пальмітинової? Написати рівняння реакцій і назвати тригліцериди, що утворюються під час реакцій.
90. Обчислити, скільки приблизно жиру витрачено для добування 11,5 т гліцерину, коли вважати, що жир – чистий тристеарин і при гідролізі вдалося розщепити лише 80% жиру.
1) ≈139 т; 2) ≈143 т; 3) ≈134 т.
91. Який витратиться об’єм водню (н.у.) для гідрогенізації 1 т жиру, що є гліцеридом олеїнової кислоти?
1) 67 м3; 2) 76 м3; 3) 82 м3.
92. Як за допомогою розчинів їдкого натру і мідного купоросу довести, що в молекулі глюкози є дві різні функціональні групи? Написати відповідні рівняння реакцій.
93. Написати рівняння таких реакцій: а) окиснення глюкози купрум(ІІ) гідроксидом; б) молочнокислого бродіння; в) відновлення глюкози в шестиатомний спирт.
94.Під час спиртового бродіння глюкози добуто 11,2 м3 карбон(ІV) оксиду (н.у.). Скільки спирту утворилося при цьому ?
1) 32 кг; 2) 26 кг; 3) 23 кг.
95. З відходів картоплі добуто 8 т глюкози. Яку кількість спирту можна добути з цієї глюкози?
1) 5 т; 2) 4 т; 3) 6 т.
96. Який об’єм карбон(ІV) оксиду можна добути внаслідок бродіння 400 кг глюкози ?
1) 89,6 м3; 2) 67,2 м3; 3) 33,6 м3.
97. Скільки молів молочної кислоти можна добути внаслідок молочнокислого бродіння 1,5 моль глюкози?
1)1 моль; 2) 0,5 моль; 3) 2 моль.
98. Як здійснити такі перетворення:
(С6Н10О5)n → С6Н12О6→ С2Н5ОН → СО2
↓
С2Н4?
99. Скільки етанолу можна добути з 1т пшениці, яка містить 70% крохмалю, якщо втрати виробництва становлять 15%?
1) 340 кг; 2) 345 кг; 3) 338 кг.
100. Скільки глюкози можна добути з 1 т картоплі, що містить 20% крохмалю, якщо вихід продукту становить 70%?
1) 145,5 кг; 2) 155,5 кг; 3) 165,5 кг.
101. Довести амфотерність таких речовин: а) алюміній гідроксиду; б) амінооцтової кислоти. Яка принципова відмінність в амфотерності цих сполук? Написати рівняння реакцій.
102. Довести, що амінооцтова кислота проявляє властивості: а) кислоти; б) основи. Написати рівняння реакцій.
103. Закінчити рівняння реакцій і зазначити в кожному випадку, які властивості – основні чи кислотні – проявляє амінооцтова кислота:
а) Н2N-СН2-СООН + КОН →
б) Н2N-СН2-СООН + НСl →.
104. Пояснити, чому розчин амінооцтової кислоти не діє на лакмус?
105. Пояснити можливість взаємодії амінокислот між собою. Підтвердити відповідь рівняннями реакцій на прикладі амінооцтової кислоти.
106. Як здійснити такі перетворення:
оцтова кислота → хлороцтова кислота → амінооцтова кислота?
Написати рівняння реакцій.
Відповіді до задач
1. б. 2. а. 3. в. 4. в. 5. б. 6. а. 7. б. 8. б. 9. в. 10. а. 11. б. 12. в. 13. а. 14. б. 15. в. 16. б. 17. в. 18. а. 19. в. 20. а. 21. а. 22. в. 23. в. 24. а. 25. а. 26. а. 27. в. 28. а. 29. а. 30. б. 31. а. 33. а. 34. б. 35. а. 36. а. 37. (1). 38. (2). 39.(2). 40. (1). 41. (1). 42. (2). 43. (1). 44. (2). 45. (1). 46. (3). 47. (2). 48. (1). 49. (1). 50. (1). 51. ( 2). 52. (2). 53. (1). 54. (2). 55. (2). 56. (3). 57. (3). 58. (2). 59. (1). 64. б,г. 68. (2). 70. (1). 71. (3). 72. (2). 73. (3). 74. (1). 75. (1). 76. б .в .г. 84. (2). 85. (2). 86. (1). 90. (1). 91. ( 2). 94. (3). 96. (1). 97. (1). 99. (3). 100. (2).
1


про публікацію авторської розробки
Додати розробку
