Урок "Алкени і алкіни: загальні та молекулярні формули, структурна ізомерія, систематична номенклатура"
На етапі актуалізації - самостійна робота на 4 варіанти.
Метою є повторити та узагальнити знання про алкени та алкіни, пояснити суть структурної ізомерії алкенів і алкінів
1
Конспект уроку
Урок № 8/4 Клас10 Дата _____ Вчитель Алхімова О. О.
Тема уроку: Алкени і алкіни: загальні та молекулярні формули, структурна ізомерія, систематична номенклатура
Навчальна мета: повторити та узагальнити знання про алкени та алкіни, пояснити суть структурної ізомерії алкенів і алкінів
Розвиваюча мета: розвивати уявлення про органічні речовини.
Виховна мета: формувати науковий світогляд учнів при вивченні теми.
Базові поняття і терміни: алкени, алкіни.
Тип уроку: комбінований.
Методи, форми та прийоми навчання: словесні, пояснювально-ілюстративні, репродуктивні, методи контролю.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва.
Структура уроку і хронометраж:
І етап. Організаційний момент (1 хв)
ІІ етап. Актуалізація і мотивація навчальної діяльності (20 хв)
ІІI етап. Вивчення нового матеріалу (13 хв)
ІV етап. Закріплення вивченого матеріалу (7 хв)
V етап. Д/з(диференційоване) (2 хв)
VІ етап. Підбиття підсумків уроку (2 хв)
Хід уроку:
І етап. Організаційний момент
Привітання.
Перевірка присутніх
ІІ етап. Актуалізація і мотивація навчальної діяльності
Самостійна робота за індивідуальними завданнями
Варіант І
Початковий рівень (1-3 бали)
1. Функціональною групою фенолів є:
- група −NH2;
- група −COOH;
- група −OH;
- група −NO2.
2. З наведених сполук виберіть ті, що належать до класу:
а) спиртів; б) карбонових кислот.
1) C3H7OH;
2) CH3CHO;
3) CH3COOH;
4) CH3NO2.
3. Будову адреналіну відбиває формула:
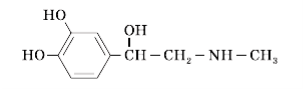
Укажіть класи, до яких можна зарахувати цю сполуку:
а) альдегіди;
б) феноли;
в) кислоти;
г) спирти;
д) кетони;
е) аміни;
ж) етери;
з) естери;
и) нітросполуки.
Середній рівень (4-6 балів)
4. Укажіть тип гібридизації атомів Карбону в молекулах органічних сполук:
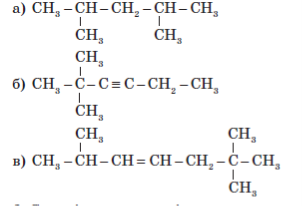
5. Зобразіть структурні формули найближчих гомологів пропану, пропену й пропіну.
Достатній рівень (7-9 балів)
6. Укажіть, який об’єм хлору приєднається до 5 л ацетилену, відповідно до рівняння:
C2H2 + 2Cl2 →C2H2Cl4
а) 5 л;
б) 10 л;
в) 2,5 л;
г) 22,4 л.
7. Обчисліть відносну густину за повітрям таких речовин: метану, етану, етену, етину. Який з цих вуглеводнів легший за повітря?
Високий рівень (10-12 балів)
8. Визначте молекулярну формулу вуглеводню, якщо масова частка Карбону в ньому становить 90 %, а відносна густина за гелієм дорівнює 30:
а) C9H12;
б) C6H 12;
в) CH4.
9. Складіть структурні формули речовин за їхніми назвами:
а) 3-етилгептан;
б) 2,4-диметилгексан;
в) 4-етил-2-метилгептан;
г) 5-етил -3,3-диметилоктан.
10. Укажіть тип гібридизації атомів Карбону в молекулах органічних сполук:
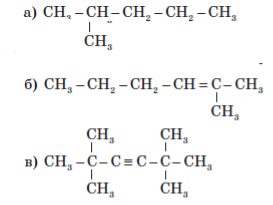
Варіант ІІ
Початковий рівень (1-3 бали)
1. Які формули називають структурними? Складіть структурні формули:
а) бутану C4H10;
б) пентену C5 H10;
в) дихлоретану C2H4Cl2.
2. Хімічну будову речовини можна схарактеризувати:
а) молекулярною формулою;
б) молекулярною масою;
в) структурною формулою.
3. Яка формула дає більше інформації про молекулу речовини – молекулярна чи структурна? Дайте докладні пояснення
Середній рівень (4-6 балів)
4. Укажіть формули речовин з однаковим якісним і кількісним складом, але різними властивостями:
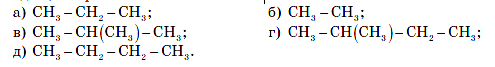
5. Які формули називаються структурними? Складіть структурні формули вуглеводню, молекулярна формула якого – C4 H10.
Достатній рівень (7-9 балів)
6. Укажіть, який об’єм водню необхідний для повного гідрування 7 л етилену, відповідно до рівняння:
C2H4+H2 →C2 H6
а) 7 л;
б) 6 л;
в) 14 л;
г) 3,5 л.
7. Обчисліть відносну густину за воднем бутану, етилену, ацетилену.
Високий рівень (10-12 балів)
8. Визначте молекулярну формулу газоподібної речовини, у якій масова частка Карбону дорівнює 80%, а Гідрогену – 20%. Відносна густина пари цієї речовини за воднем дорівнює 15.
9. Побудуйте ізомери складу C2H6O. До якого класу органічних сполук можна віднести ці речовини?
10. Визначте тип гібридизації атомів Карбону в сполуках і вид хімічного зв’язку між атомами в цих молекулах:
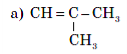
Варіант ІІІ
Початковий рівень (1-3 бали)
- Що таке функціональна група? Які функціональні групи вам відомі? Наведіть приклади (формули, назви) сцолук, що містять функціональні групи
- Що таке гомологи? Наведіть приклади (формули, назви) гомологів метану.
- Наведіть приклади природних і синтетичних органічних речовин
Середній рівень (4-6 балів)
- Укажіть, які з наведених нижче речовин є ізомерами C5H12:
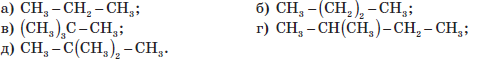
- Позначте перелік, у якому подано лише органічні речовини.
А Капрон, метан, сірка, цемент;
Б каучук, капрон, поліетилен, соняшникова олія;
В вовна, целюлоза, гас, амоніак;
Г ацетилен, нафтален, вольфрам, оцтова кислота.
Достатній рівень (7-9 балів)
- Що таке повне і часткове окиснення вуглеводнів? Наведіть приклади.
- Обчисліть відносну густину за киснем бутану, етилену, ацетилену
Високий рівень (10-12 балів)
- Органічна речовина містить 85,7% Карбону та 14,3% Гідрогену. Відносна густина пари цієї речовини за воднем дорівнює 14. Визначити молекулярну формулу речовини.
- Складіть структурні формули таких сполук:
а) 2,2 –диметилпропану;
б) 2-метилпропену.
Варіант IV
Початковий рівень (1-3 бали)
1. Речовини, подібні за будовою і хімічними властивостями, склад яких відрізняється між собою на одну або декілька – СН2 – груп, називаються:
- гомологами;
- вуглеводнями;
- ізомерами;
- полімерами.
2. Позначте загальну формулу алкенів:
- СnН2n+2
- СnН2n+1
- СnН2n-2
- СnН2n
- Речовини, що мають однаковий склад та відносну молекулярну масу, але відрізняються будовою молекул, називаються:
А) гомологами;
Б) ізомерами;
В) полімерами;
Г) вуглеводнями.
Середній рівень (4-6 балів)
- Позначте структурну формулу, що відповідає гептану:
А) CH3 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3;
Б) CH3 – CH = CH – CH2 – CH3;
В) CH3 – CH = CH2;
Г) CH3 – CH2 – CH2 – CH2 – CH2 – CH3.
- Установіть послідовність розташування речовин в гомологічному ряді алканів:
А) октан;
Б) гексан;
В) бутан;
Г) декан.
Достатній рівень (7-9 балів)
6. Укажіть, який об’єм водню необхідний для повного гідрування 7 л етилену, відповідно до рівняння:
C2H4+H2 →C2 H6
а) 7 л;
б) 6 л;
в) 14 л;
г) 3,5 л.
7. Обчисліть відносну густину за гелієм бутану, етилену, ацетилену.
Високий рівень (10-12 балів)
8. Визначте молекулярну формулу вуглеводню, масова частка Карбону в якому дорівнює 85,7%. Відносна густина вуглеводню за воднем дорівнює 21.
9. Складіть структурні формули таких сполук:
- 2,2 – диметилбутан;
- 2-метилнонан.
- Складіть формули ізомерів гексану та назвіть їх за систематичною номенклатурою.
ІІI етап. Вивчення нового матеріалу
Сьогодні ми пригадаємо, загальні та молекулярні формули алкенів та алкінів, дізнаємося про структурну ізомерію та систематичну номенклатуру
- Загальна характеристика ненасичених вуглеводнів
(Упродовж уроку заповнюється порівняльна схема.)
|
Характеристика |
Алкани (парафіни, метанові) |
Алкени (етиленові) |
Алкіни (ацетиленові) |
|
Загальна формула |
CnH2n+2 |
CnH2n |
CnH2n-2 |
|
Гомологічний ряд |
CH4, C2H6, C3H8, …
CH4 – метан
Н │ Н – С – Н │ Н метан
|
C2H4, C3H6, C4H8, …
C2H4 – етилен
Н – С = С – Н │ │ Н Н
Н2С = СН2 Етен |
C2H2, C3H4, C4H6, …
C2H2 – ацетилен
Н – С ≡ С – Н
НС ≡ СН етин |
- Чому гомологічні ряди алкенів і алкінів починаються з вуглеводнів, що містять два атоми Карбону, а не один, як в алканів?
(За загальною формулою виходять формули речовин CH2 і CH0, що не відповідає валентності Карбону)
Лабораторний дослід. Складання моделей молекул вуглеводнів.
- Складіть моделі молекул етану, етилену й ацетилену.
- Зробіть висновок про відмінності в будові й міцності зв’язків у цих молекулах.
|
Види зв’язків |
С – Н σ-зв'язок С – С σ-зв'язок |
С – Н σ-зв'язок С = С σ- і π-зв'язки |
С – Н σ-зв'язок С ≡ С σ- і 2π-зв'язки |
|
Гібридизація |
sp3 |
sp2 |
Sp |
π -зв’язок – це ковалентний зв’язок, що виникає внаслідок перекривання орбіталей по обидва боки від лінії, що з’єднує центри атомів, які зв’язуються.
π-зв’язок менш міцний, ніж σ-зв’язок.
Розгляньмо моделі молекул етену й етину.
Чому рухливість атомів Карбону навколо кратного зв’язку обмежена?
|
Характеристика |
Алкани (парафіни, метанові) |
Алкени (етиленові) |
Алкіни (ацетиленові) |
|
Види ізомерії |
Структурна (починається із бутану) |
Структурна: ізомерія карбонового ланцюга; ізомерія положення кратного зв’язку |
|
|
Номенклатура |
1. Визначити головний ланцюг. 2. Нумерація головного ланцюга починається з того кінця, до якого ближче замісник. С1Н3 – С2Н – С3Н3 │ СН3 2-метилпропан |
Суфікс у назві головного ланцюга для алкенів – ен(-єн). Суфікс у назві головного ланцюга для алкінів – ин(-ін С1Н2 =С2Н – С3Н2 – С4Н3 бут-1-ен С1Н3 – С2Н = С3Н – С4Н3 бут-2-ен С1Н ≡С2 – С3Н2 – С4Н3 бут-1-ин С1Н3 – С2 ≡ С3 – С4Н3 бут-2-ин |
|
*Однією з причин різноманіття органічних сполук є міжкласова ізомерія – явище існування ізомерів з різних класів органічних сполук. Наприклад, для алкенів міжкласовими ізомерами будуть циклоалкани: бутен – циклобутан.
Зобразіть структурні формули цих сполук – і переконаєтеся в правильності твердження про їх ізомерію.
Для алкінів міжкласовими ізомерами будуть, наприклад, органічні сполуки, що містять два подвійні зв’язки. Запропонуйте структурні формули таких ізомерів для бутину й бутадієну.
ІV етап. Закріплення вивченого матеріалу
Дайте назви речовинам за структурними формулами:
- СН2 = С – СН3
│
СН3
- СН2 = СН – СН – СН3
│
СН3
- СН ≡ С – СН – СН3
│
СН3
- СН3 – С ≡ С – СН3
V етап Д/з(диференційоване)
Електронний підручник Попель П. П., Крикля Л. С.
§8, с. 45-49, виконати завдання №52, 53, с.49; §10, с. 55-59, виконати завдання №63, 64, *71, с.59-60
VІ етап. Підбиття підсумків уроку
Оцінюювання


про публікацію авторської розробки
Додати розробку
