Урок "Алотропія" з розділу "Неметалічні елементи та їх сполуки"
Тема Алотропія. Значення озонового шару для життя на Землі.
Мета:Ознайомити учнів з явищем алотропії, з’ясувати причини відмінності у властивостях алотропних модифікацій речовин на прикладі алотропних видозмін О, S, C, P. Сформувати уявлення про залежність якісних і кількісних характеристик речовин від їхньої будови на прикладі О2 і О3. Показати значення озонового шару для життя організмів на Землі, вплив діяльності людини на процеси на прикладі озонового шару.
Формування ключових компетентностей: спілкування державною мовою, спілкування іноземною мовою, екологічна грамотність і здорове життя, уміння вчитися впродовж життя
Наскрізні змістові лінії:
- Екологічна безпека і сталий розвиток
- Громадянська відповідальність
- Здоров'я і безпека
Тип уроку: засвоєння нових знань.
Форми роботи: фронтальна бесіда, робота з підручником, розповідь вчителя.
Хід уроку
І. Актуалізація опорних знань
1. На які 2 групи можна поділити всі хім. елементи?
2. Де розташовані неметали в ПСХЕ ?
3. Які особливості будови атомів неметалів ви можете назвати?
ІІ. Мотивація навчальної діяльності
Today we’ll have an unusual lesson. We’ll speak English at Chemistry.
Teacher: What chemical elements are these?
1. It is the seventh chemical element of the periodic table. It is in the cell between carbon and oxygen. (Nitrogen)
2. It is the first element in the group of halogen gases. (fluorine)
3. It is one of those elements that you will never find free in nature. It is very reactive. (Phosphorus)
4. It is the eighth element of the periodic table and in the second period. (Oxygen)
ІІІ. Вивчення нового матеріалу
Назви неметалічних елементів – неметалів за сучасною номенклатурою
|
Хімічний елемент |
Проста речовина |
|
Н Гідроген |
Н2 водень |
|
N Нітроген |
N2 азот |
|
O Оксиген |
O2 кисень О3 озон |
|
F Флуор |
F2 фтор |
|
Cl Cl Хлор |
Cl2 хлор |
|
Br Br Бром |
Br2 бром |
|
I І Йод |
I2 йод |
|
C С Карбон |
C вуглець (графіт, алмаз, карбін, С60 фулерен) |
|
Sі Sі Силіцій |
Sі силіцій |
|
S S Сульфур |
S8 ромбічна сірка, кристалічна сірка, Sп пластична сірка |
|
P Фосфор |
P4 білий фосфор, Р червоний фосфор |
Алотропія
Алотропія -явище існування одного і того самого хімічного елемента у вигляді кількох простих речовин, що відрізняються між собою будовою та властивостями.
Алотропні модифікації – прості речовини, утворені одним і тим самим хімічним елементом.
1. Різна кількість атомів у молекулі.
2. Різна структура кристалів.
Алотропні модифікації Оксигену
![]()
![]()
кисень О2 озон О3
- Порівняємо властивості кисню і озону
https://www.youtube.com/watch?v=ChDKL5o-4XM
https://www.youtube.com/watch?v=1cBtV897Fas
2. Утворення озону у верхніх шарах атмосфери внаслідок поглинання киснем ультрафіолетового випромінювання Сонця, а також під час грози.
3О2 = 2О3
3. Озон, розкладаючись, легко перетворюється на кисень
О3 + һυ = О2 + О 2О3 = 3О2
4. Роль озонового шару.
а) знаходиться на висоті 20 – 40 км від поверхні Землі.
б) О3 затримує ультрафіолетове і електромагнітне випромінювання Сонця, що є небезпечним для усього живого.
5. Вплив людини на озоновий шар.
а) під впливом природних факторів озон руйнується (фотохімічний розклад, виверження вулканів), але й швидко відновлюється.
б) негативно впливає господарська діяльність людини – техногенна причина руйнування озону:
- фреони – орг. сполуки, що містяться в аерозольних упаковках, охолоджувальних системах холодильників;
- викиди в атмосферу вихлопних газів реактивних літаків, що містять N.
6. Озонові дірки
- уперше виявили у 1985р над Антарктидою;
- над Україною вміст О3 за останні 20р. зменшився на 6%;
- наслідки: захворювання очей (влітку носіть окуляри), захворювання шкіри (утримуйтесь від загару), онкозахворювання.
-у 1987р. прийнято Монральський протокол за яким з метою збереження озонового шару з виробництва знімаються речовини. що його руйнують. У1991р. Україна приєдналася до цього рішення.
Алотропні модифікації Карбону
![]()
![]()
![]()
алмаз графіт карбін фулерен
кожен атом Карбону атоми Карбону розташовані = С=С=С=С= С60
з’єднаний із 4 іншими шарами, в шарах атоми об’єднані - С≡ С - С≡С- нагадує
атомами міцними ков. у шестиатомні кільця. (спочатку добули футбольний
зв’язком. синтетичний, а м’яч.
потім виявили у (штучно
1.Немолекулярної 1.Немолекулярної природі) створена
будови. будови. модифікація)
2.Дуже твердий. 2.Відносно м’який.
3.Прозорий,безбарвний. 3.Непрозорий,сірий, з металічним блиском.
4.Тугоплавкий 4.Тугоплавкий.
5.Діелектрик 5.Приводить струм і тепло.
6.Дуже заломлює світло, 6.Масний на дотик.
Застосування:
- прикраси(діаманти) - олівці
- для різання скла - графітна смазка
- буріння гірських порід - електроди
- шліфувальні диски - труби теплообмінників
- різці, свердла - добування штучних алмазів
- уповільнювач нейтронів
Работа з текстами в групах.
Teacher: Now you’ll work in groups. Your task is to read short texts paying attention to the words under the text. Try to understand it and then retell it in Russian. Time for reading is 2 minutes, for discussion in groups – 1 minute.
Group 1. A diamond is crystalline modification of pure carbon. The word 'diamond' is from Greek, it means 'hardest steel' or 'hardest substance'. Everyone knows diamonds are hard and beautiful, it is a brilliant precious stone, but did you know a diamond could be the oldest material you might own? While the rock in which diamonds are found may be 50 to 1,600 million years old, the diamonds themselves are approximately 3.3 billion years old. Diamonds also may be formed under the high pressures and temperatures at the site of meteorite impacts. Diamond is made up of repeating units of carbon atoms joined to four other carbon atoms. The structural unit of diamond consists of 8 atoms, fundamentally arranged in a cube. This network is very stable, that is why diamonds are so very hard and have a high melting point. They are used in industry, they are the best and the most expensive jewelry.
Group 2. Graphite is the second allotropian modification of a carbon. It is soft, black substance. Since early times people used pieces of soft mineral, graphite, as a writing instrument. Graphite has a stratified, scaly structure. During the friction graphite looses its layers and leaves them on objects. The origin of the word “graphite” comes from Greek ‘grafo” which means “write”. Later people began to make sticks out of graphite. To protect hands from graphite they started to cover graphite sticks with different materials. The evolution of graphite writing instrument has brought to the creation of a pencil which we still use. Graphite is used as a crucible for melting metals, in pencils, for rust protection, for lubrication, and as a moderator for slowing neutrons for atomic fission.
Group 3. FULLERENES, a group of specific molecules, consisting only of atoms of carbon, which form a framework out of 12 pentagons and a few hexagons. Fullerenes are a family of carbon allotropes, molecules composed entirely of carbon, in the form of a hollow sphere, ellipsoid, tube, or plane. These combinations got their name after engineer and designer R.Backminster Fuller. The fullerene was discovered in 1985 at the University of Sussex and Rice University, who named it after Richard Buckminster Fuller. As the discovery of the fullerene family came after buckminsterfullerene, the shortened name 'fullerene' was used to refer to the family of fullerenes. Fullerene have unusual chemical and physical properties. So, at high pressure C60 becomes hard, as a diamond. Due to this property of C60 it is possible to use it as a hard greasing substance.
Алотропні модифікації Фосфору
![]()
![]()
![]()
Білий фосфор ( Р4) Червоний фосфор Чорний фосфор
1.Молекулярна гратка 1.Атомна гратка 1.Атомна гратка
2. М’яка кристалічна реч. 2.Порошок червоного кольору. 2.Схожий на графіт
схожа на віск. 3.Нелеткий 3.Напівпровідник
3.Безбарвний, прозорий. 4.Без запаху. 4.Не отруйний
4.Леткий. 5.Не отруйний. 5.Має металічний 5.Запах часнику. 6.Гігроскопічний блиск.
6.Легкоплавкий. 7.Не розчинний у воді. 6.Не розчинний у 7.Не розчинний у воді. воді.
8.Світиться.
9.Отруйний.
Використовують у сірниках.
ІV. Узагальнення набутих знань.
- Чому хімічних елементів менше, ніж простих речовин,що вони утворюють?
- Що таке – алотропні модифікації?
- Гра з кубиком. Назвати алотропні модифікації О, С, Р, S.
- Чим можна пояснити утворення одним елементом кількох простих речовин?
Які причини алотропії?
- Що сталося б із Землею, якби повністю зник озоновий шар?
Кроссвород
Teacher: Now let’s see how well you have understood the lesson and learnt the chemical elements. Do the crossword in pairs.
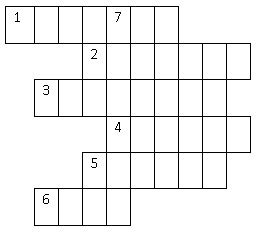
- This element has atomic number of 14. (silicon)
- This element is of 4 period 2 group A (calcium)
- It has 1 proton. (hydrogen)
- This element has atomic mass of 137,34. (barium)
- This element’s symbol is Cu. (copper)
- This element is 4 period 8 group B. (iron)
- What is the seventh element? (carbon)
Well done. Thank you very much.
V. Домашнє завдання
§2 ст. 11-16, § 9 ст. 42-43, §19 ст. 74-77.
VІ. Підведення підсумків уроку


про публікацію авторської розробки
Додати розробку
