Урок "Багатоатомні спирти. Гліцерол"
Тема: Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості, застосування.
Мета: розширити знання учнів про оксигеновмісні органічні сполуки на прикладі багатоатомних спиртів; формувати знання про етиленгліколь і гліцерин як органічні сполуки, що містять декілька функціональних груп, - багатоатомні спирти; ознайомити учнів з молекулярними та структурними формулами багатоатомних спиртів, їхніми фізичними властивостями; порівняти хімічні властивості одноатомних та багатоатомних спиртів; формувати навички складання рівнянь реакцій, що описують хімічні властивості та способи добування багатоатомних спиртів.
Обладнання та матеріали: штатив з пробірками, хімічні склянки; металічний натрій; розчини натрій гідроксиду (калій гідроксиду), купрум сульфату, гліцерол.
Базові поняття і терміни: спирти, багатоатомні спирти, функціональна група, водневий зв’язок, якісна реакція.
Форми роботи: фронтальне опитування, бесіда, групова робота, перегляд відеодослідів.
Досліди:
1) розчинення гліцеролу у воді https://www.youtube.com/watch?v=cx9miYK_y9w
2) взаємодія гліцеролу з натрієм https://www.youtube.com/watch?v=Xqyykg8gCTQ
3) якісна реакція на гліцерол
https://www.youtube.com/watch?v=STwpBjllmgY
Тип уроку: комбінований.
Структура уроку
- Організаційний етап.
- Перевірка домашнього завдання.
- Актуалізація опорних знань.
- Вивчення нового матеріалу.
- Поняття про багатоатомні спирти
- Структура багатоатомних спиртів.
- Номенклатура багатоатомних спиртів.
- Фізичні властивості багатоатомних спиртів.
- Хімічні властивості багатоатомних спиртів у порівнянні з одноатомними.
- Методи одержання багатоатомних спиртів.
- Застосування багатоатомних спиртів.
V. Узагальнення й систематизація знань учнів.
VI. Підбиття підсумків уроку
VII. Домашнє завдання.
Хід уроку
- Організація класу.
- Перевірка домашнього завдання.
- Актуалізація опорних знань. Мотивація навчальної діяльності.
Фронтальна робота.
- Укажіть загальну формулу насичених одноатомних спиртів.
|
А СnH2n +2 |
В СnH2n +1OH |
|
Б СnH2n+1COOH |
Г СnH2n+1CHO |
- Укажіть назву характеристичної (функціональної) групи спиртів.
|
А карбоксильна |
В аміногрупа |
|
Б гідроксильна |
Г карбонільна |
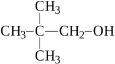
- Укажіть ізомер н-бутанолу.
|
А |
|
Б |
|
В |
|
- Укажіть зв’язки, що утворюються між молекулами етанолу.
|
А ковалентні полярні |
В йонні |
|
Б ковалентні неполярні |
Г водневі |
|
|
|
- Укажіть назву речовини, молекулярна формула якої C3H7OH.
|
А етанол |
В бутанол |
|
Б пропан |
Г пропанол |
- Увідповідніть структурну формулу спирту з його назвою.
|
Структурні формули |
Назви спиртів |
|
А CH3 – CH – ОH
|
|
|
Б CH3 – CH2 – CH – CH3
|
|
|
В CH3 – ОH |
5 бутан-2-ол |
|
Г CH3 – CH– CH2 – ОН
|
|
- Установіть послідовність застосування реагентів відповідно до схеми перетворень:
C2H2 (1) → С2Н4 (2)→ С2Н5Cl (3)→ C2H5OH (4)→ C2H5ONa
А) + HCl; Б) + Na; В) + NaOH; Г) + H2 .
- Увідповідніть рівняння хімічної реакції з її типом.
|
Рівняння хімічних реакцій |
Типи реакції |
|
А C2H5OH + 3O2 → 2CO2 + 3H2O |
1 часткове окиснення |
|
Б C2H5OH + HBr → C2H5Br + H2O |
2 дегідратація |
|
В C2H5OH → CH2 = CH2 + H2О |
3 повне окиснення |
|
Г 2CH3OH + O2 → 2НСОН + 2H2О |
4 гідратація |
|
|
5 заміщення |
- Вивчення нового матеріалу.
- Поняття про багатоатомні спирти.
Спирти, молекули яких містять декілька гідроксильних груп відносять до багатоатомних спиртів. Або багатоатомними називаються спирти, у молекулах яких два або більше атомів Гідрогену заміщені на гідроксогрупи ОН. Якщо в молекулі дві групи ОН – це двохатомні спирти –діоли. Якщо в молекулі спирту містяться три гідроксигрупи, він належить до триатомних спиртів. У назві такого багатоатомного спирту присутній суфікс -тріол.
- Структура багатоатомних спиртів.
Загальна формула двохатомних спиртів CnH2n(OH)2, триатомних спиртів CnH2n-1(OH)3.
![]() CH₂ − OH
CH₂ − OH
![]()
![]() CH – OH CH2 – OН
CH – OH CH2 – OН
CH₂ − OH CH₂ − OН
Найпростішим представником двоатомних спиртів є етиленгліколь або гліколь, триатомних спиртів – гліцерол (гліцерин).
Формула етандіолу ( етиленгліколю) СН2ОН –СН2ОН (С2Н4(ОН)2), пропантріолу-1,2,3 (гліцеролу): СН2ОН –СНОН –СН2ОН (С3Н5(ОН)3).
- Номенклатура багатоатомних спиртів.
Двоатомні спирти називають також діолами або гліколями (від гр. glykys – солодкий), через солодкий смак найпростіших представників цих спиртів; триатомні – тріолами або гліцеролами, за назвою першого представника. За замісниковою номенклатурою ІЮПАК назви дво- та триатомних спиртів утворюють від назви відповідного вуглеводню, додаючи суфікс –діол чи - тріол, позначаючи цифрами положення гідроксильних груп.
- Фізичні властивості багатоатомних спиртів.
Розповідь учителя.
З-поміж загальних фізичних властивостей багатоатомних спиртів необхідно відзначити, що це в’язкі речовини, добре розчинні у воді й погано розчинні в органічних розчинниках.
Властивості багатоатомних спиртів визначаються наявністю водневого зв’язку. Більша кількість гідроксильних груп зумовлює утворення більшої кількості водневих зв’язків. Це зумовлює велику в’язкість і високу температуру кипіння цих речовин, а також розчиненність їх у воді та інших спиртах.
Етиленгліколь- безбарвна сиропоподібна рідина, солодкувата на смак, добре розчиняється у воді та спирті. Температура кипіння +197,90С, температура плавлення -12,60С, густина 1,12 г/мл. Надзвичайно отруйний!
Гліцерол – безбарвна сиропоподібна, дуже в’язка рідина, не отруйна, солодкувата на смак. Температура кипіння +2900С, температура плавлення +18,20С, густина 1,26 г/мл. З водою змішується у будь-яких співвідношеннях, дуже гігроскопічний.
(Учні самостійно виписують з підручника та інтернет-джерел, потім озвучують отриману інформацію)
Завдання: заповнити картку-характеристику.
Фізичні властивості гліцеролу:
Запах_________________________ (відсутній)
Консистенція __________________ (густий, трошки схожий на олій часту речовину)
Смак ______________________ (солодкуватий)
Розчинність у воді _______________________ (добре розчинний)
Гігроскопічність _____________________ (дуже гігроскопічний)
Висновок: багатоатомні спирти - безбарвні, сиропоподібні, в’язкі рідини солодкуваті на смак, добре розчинні у воді, погано - в органічних розчинниках; мають високі температури кипіння. Змішуються у всіх співвідношеннях з водою та етиловим спиртом.
Дослід 1. Розчинення гліцеролу у воді.
https://www.youtube.com/watch?v=cx9miYK_y9w
- Хімічні властивості багатоатомних спиртів у порівнянні з одноатомними.
Давайте з’ясуємо чи впливає будова молекули етиленгліколя та гліцеролу на їхні властивості хімічні?
Групова робота. Група 1: дослідження властивостей багатоатомних спиртів. Група 2: способи добування. Група 3: галузі застосування багатоатомних спиртів. Представлення результатів роботи.
Розповідь учителя.
Для багатоатомних спиртів характерними є основні реакції одноатомних спиртів. На відміну від останніх вони можуть утворювати похідні за однією або кількома гідроксильними групами, залежно від умов проведення реакцій.
- Повне окиснення (горіння)
Завдання: складіть рівняння реакцій горіння для етиленгліколю та гліцеролу.
С2Н4(ОН)2 + О2 → СО2 + Н2О
С3Н5(ОН)3 + О2 → СО2 + Н2О
- Реакції заміщення за участю гідроксогруп.
а) Взаємодія з активними металами
![]()
![]() CH₂ − OH CH₂ − ONa
CH₂ − OH CH₂ − ONa
![]()
![]() 2 CH – OH + 6 Na → 2 CH – ONa + 3 H₂
2 CH – OH + 6 Na → 2 CH – ONa + 3 H₂
CH₂ − OH CH₂ − ONa
Завдання: складіть рівняння реакцій для етиленгліколя та гліцерола в молекулярній формі.
С2Н4(ОН)2 + Na → С2Н4(ОNa)2 + H2
С3Н5(ОН)3 + Na → С3Н5(ОNa)3 + Н2
Дослід 2. Взаємодія гліцеролу з металічним натрієм.
https://www.youtube.com/watch?v=Xqyykg8gCTQ
б) Взаємодія з гідрогенгалогенідами
![]()
![]() CH₂ − OH CH₂ − Cl
CH₂ − OH CH₂ − Cl
![]()
![]() CH – OH + 3HCl → CH – Сl + 3H₂O
CH – OH + 3HCl → CH – Сl + 3H₂O
CH₂ − OH CH₂ − Cl
Завдання: складіть рівняння реакцій для етиленгліколя та гліцерола в молекулярній формі.
С2Н4(ОН)2 + 2HCl → С2Н4Cl2 + 2H2O
С3Н5(ОН)3 + 3HCl → С3Н5Cl3 + 3Н2O
- Взаємодія з нітратною кислотою. Утворення тринітрогліцеролу (складний ефір)
![]()
![]() CH₂ − OH CH₂ − O − NO₂
CH₂ − OH CH₂ − O − NO₂
![]()
![]() CH – OH + 3 HNO₃ → CH – O − NO₂ + 3 H₂O
CH – OH + 3 HNO₃ → CH – O − NO₂ + 3 H₂O
CH₂ − OH CH₂ − O − NO₂
Завдання: складіть рівняння реакції в молекулярній формі.
С3Н5(ОН)3 + 3HNO3 → С3Н5(ONO2)3 + 3Н2O
- Порівняно з одноатомними спиртами, багатоатомні спирти виявляють сильніші кислотні властивості. На відміну від одноатомних спиртів гліцерол взаємодіє з основами. Реакція зі свіже виготовленим купрум (ІІ) гідроксидом є якісною реакцією. В результаті реакції блакитний осад Cu(OH)₂ взаємодіє з гліцеролом і перетворюється в синій розчин. Подібну реакцію дає і етиленгліколь.
![]()
![]() CH₂ − OH CH₂ − OH
CH₂ − OH CH₂ − OH
![]()
![]()
![]()
![]() CH – OH + Cu(OH)₂ → CH – O + 2 H₂O
CH – OH + Cu(OH)₂ → CH – O + 2 H₂O
![]()
CH₂ − OH CH₂ − O
купрум (ІІ) гліцерат
Дослід 3. Якісна реакція на гліцерол.
https://www.youtube.com/watch?v=STwpBjllmgY
- Методи одержання багатоатомних спиртів.
Розповідь учителя.
- Гідратація етиленових вуглеводнів у присутності окисників:
СН2=СН2+ [О] +Н2О → СН2ОН—СН2ОН
- Гідроліз галогенопохідних алканів водними розчинами лугів:
С2Н4Cl2 + 2КОН = С2Н4(ОН)2 + 2КCl
С3Н5Cl3 + 3КОН = С3Н5(ОН)3 + 3КCl
- Лужний гідроліз жирів.
- Застосування багатоатомних спиртів.
Розповідь учителя.
Етиленгліколь і гліцерол використовуються в промисловому органічному синтезі. Гліцерин застосовують для виробництва мастил, як зм'якшувач шкіри і тканин, у парфюмерній, косметичній, фармацевтичній і харчовій промисловості. Водні розчини етиленгліколю і гліцеролу замерзають при низьких температурах, тому їх використовують як антифризи - рідини з низькою температурою замерзання, які застосовуються для охолодження двигунів внутрішнього згоряння.
Етиленгліколь і пропіленгліколь використовуються при виготовленні антифризу для автомобілів, при виробництві розчинників, входять до складу гальмівної рідини.
Гліцерол за рахунок своєї гігроскопічності використовується для пом’якшення шкіри в шкіряній промисловості і фармації. Застосовується в паперовій, поліграфічній, парфумерній і фармакологічній промисловості. Входить до складу гальмівної рідини, пластифікаторів, алкідних і епоксидних лаків. Нітрогліцерин – надзвичайно вибухонебезпечна речовина, а його 1%-й розчин використовується як ліки при серцево-судинних захворюваннях.
- Узагальнення та систематизація знань.
Робота над завданнями.
- Речовина містить 39,1% Карбону, 8,7% Гідрогену та 52,2% Оксигену. Виведіть її молекулярну формулу, якщо молярна маса речовини - 92 г/моль.
- Обчисліть масу (г) гліцеролу, що вступить у реакцію з металічним натрієм масою 13,8 г.
- Обчисліть об’єм (л) кисню (н.у.), який необхідно використати на спалювання гліцеролу масою 9,2 г.
- Скласти рівняння реакцій за схемою перетворень
С3Н8 → С3Н5Cl3 ↔ C3H5(OH)3 → C3H5(ONa)3
C2H6 → C2H4Cl2 ↔ C2H4(OH)2 → CO2
- Укажіть молекулярну формулу гліцеролу.
|
А C3H5(ОН)3 |
В СH3ОН |
|
Б С2Н5ОН |
Г С3Н7ОН |
-
Укажіть характеристики, що відносяться до гліцеролу.
- безбарвна в’язка, солодка на смак рідина
- безбарвна рідина, має різкий специфічний запах
- застосовується для виготовлення настоянок
- у воді розчиняється в необмеженій кількості
- у холодній воді розчиняється погано
- використовується як зм’якшувальний засіб у парфумерії
|
А 1, 2, 5 |
В 2, 3, 4 |
|
Б 1, 4, 6 |
Г 3, 4, 6 |
- Укажіть спільну ознаку, характерну для етанолу та гліцеролу.
А за нормальних умов тверді речовини
Б взаємодіють із металічним натрієм
В містять декілька гідроксильних груп
Г мають однаковий колір полум’я під час горіння
- У дві пробірки налили по 2-3 мл етанолу і гліцеролу. У кожну пробірку добавили свіжоосаджений купрум(ІІ) гідроксид і ретельно перемішали реагенти. Проаналізуйте наведені твердження.
І. У пробірці з етанолом випав осад синього кольору.
ІІ. У пробірці з гліцеролом утворився розчин синього кольору.
|
А правильне лише І |
В немає правильних |
|
Б правильне лише ІІ |
Г обидва правильні |
- Підбиття підсумків уроку. Оцінення учнів.
Закінчити речення. На цьому уроці я ….
- Домашнє завдання.
Підручник (П.П. Попель, Л.С. Крикля): прочитати §15, розв’язати №113 с.94


про публікацію авторської розробки
Додати розробку