Урок. Білки, їхня структурна організація та основні функції.
1
Урок № 5
Тема: Білки, їхня структурна організація та основні функції.
Мета уроку:
Освітня. Формувати знання про білки, рівні їх структурної організації, , вивчити особливості будови, їх властивості та функції,встановлювати взаємозв’язки між будовою та функціями білків;
Розвиваюча. Розвивати уміння логічно мислити, спостерігати та робити відповідні висновки,сприяти розвитку вміння долати труднощі, розвивати пізнавальні можливості, самостійність, самовдосконалення, увагу, пам’ять, формувати оптимальний харчовий раціон;
Виховна. Виховувати позитивне ставлення до навчання. виховна: пробудити в пізнавальній, творчій, прививати культуру поведінки в колективі, повагу до думки іншого.
Тип уроку. вивчення нового матеріалу.
Методи і методичні прийоми:
1. Інформаційно- рецептивний:
а) словесний: розповідь-пояснення, опис, бесіда, робота з підручником та м\медійною дошкою;
б)наочний: ілюстрація, демонстрація, ТЗН.
Прийоми навчання: : виклад інформації, пояснення, активізація уваги та мислення, одержання з тексту та ілюстрацій нових знань, робота з роздатковим матеріалом.
2. Репродуктивний.
Прийоми навчання: подання матеріалу в готовому вигляді, конкретизація і закріплення вже набутих знань.
3. Проблемно-пошуковий: постановка проблемного питання.
Прийоми навчання: постановка взаємопов’язаних проблемних запитань, активізація уваги та мислення.
4.Візуальний: складання схематичних малюнків.
5.Сугестивний: застосування різних видів мистецтва
6.Релаксопедичний: фізкультхвилинка.
Міжпредметні зв ́язки: хімія, екологія, основи здоров'я.
Матеріали та обладнання: таблиці, які ілюструють особливості будови, різноманіття та функції білків, або мультимедійний проектор чи інтерактивна дошка, на яких ці таблиці можна демонструвати; підручники біології,ПК, презентація, підручник, роздатковий матеріал.
Основні поняття та терміни: білки; пептидна група, пептидний зв'язок, денатурація, деструкція, ренатурація.
Хід уроку
1.Організаційний етап
1.1. Привітання.
1.2. Перевірка готовності класного приміщення до уроку.
1.3. Перевірка готовності учнів до уроку.
1.4. Перевірка присутності учнів: кількість за списком ____, кількість присутніх на уроці ___, відсутніх ___.
2. Актуалізація опорних знань
Питання для бесіди
1. Які елементи трапляються в живих організмах частіше, ніж у сполуках неживої природи?
2. Які функції в живих організмах виконує вода?
3. Навіщо живим організмам потрібні мінеральні речовини?
3. Мотивація навчальної діяльності
Вчитель пропонує виконати вправу «Розминка»
Завдання: розв’яжіть анаграми на терміни, що пов'язані з нашим заняттям. Як саме пов’язані і чому?
Ілбок (білок)
Ліпоптпеди (поліпептид)
Аткаізларот (каталізатор)
(Учні вирішують анаграми, та висловлюють припущення, яким чином терміни пов’язані з темою)
4. Повідомлення теми, мети і завдань уроку
4.1. Повідомлення теми уроку. «Білки, їхня структурна організація та основні функції»
4. 2. Формулювання учнями самостійно мети і визначення завдань уроку. Учитель записує їх на дошці та коригує пропозиції учнів.
Завдання уроку:
Ознайомитися із структурною організацією та функціями білків; проаналізувати особливості будови й властивості білків, які дозволяють їм ефективно виконувати свої функції;
Очікувані результати:
-характеризувати структурні рівні організації білків;
-пояснювати роль білків у життєдіяльності організмів;
-встановлювати зв’язки між будовою та функціями білків;
-спостерігати та описувати властивості білків;
-висловлювати судження про необхідність різних продуктів харчування у раціоні людини;
- робити висновки про єдність хімічного складу організмів та спільність
складу хімічних елементів у живій та неживій природі та про відмінності у складі хімічних сполук між живою та неживою природою.
5.Засвоєння нового матеріалу
План пояснення нового матеріалу
Розповідь учителя з елементами бесіди
1. Будова та властивості білків.
2. Рівні структурної організації білків.
3. Класифікація білків.
4. Властивості білків
5. Функції білків
1. Будова та властивості білків.
Білки – це високомолекулярні органічні сполуки, що побудовані із залишків -амінокислот, які з’єднані між собою пептидними зв’язками в довгі поліпептидні ланцюги.
Хімічний склад білків:
Карбон С – 50-55% Оксисен О – 19-24%
Сульфур S - 0,2-2,4% Гідроген Н – 6,5-7,3%
Нітроген N – 15-19%
2. Рівні структурної організації білкової молекули
2.1. Характеристика первинної структури білкової молекули
Вивчення амінокислотного складу білків ще не дає повного уявлення про їх будову. Відомо, що властивості білків залежать не тільки від кількісного і якісного амінокислотного складу, а и від послідовності розміщення залишків амінокислот у поліпептидному ланцюзі та просторової конфігурації молекули білка. Кожен білок має постійний склад і точне значення молекулярної маси. Практично всі білки побудовані з 20 амінокислот. Амінокислоти з’єднані між собою пептидними зв’язками.
На початку 50-х рр. XX ст. була висунута ідея про три рівні організації білкових молекул (К.Лідерстрем-Ланг, 1953 р.). Учений припустив, що молекули білка є поліпептидами, а компактна форма пояснюється укладанням у просторі (просторова структура).
Особливістю білків, яка має вирішальне значення для їх функціонування, є здатність самовільно формувати просторову структуру, властиву лише даному білку (так звана самоорганізація структури). Згідно із сучасними уявленнями, розрізняють чотири рівні організації білкової молекули. Послідовність амінокислотних залишків у поліпептидному ланцюзі називають первинною структурою. Усі білки розрізняються за первинною структурою.
Молекули білків побудовані з великої кількості амінокислотних залишків, а тому вивчення їх первинної структури викликає певні труднощі. Завдяки використанню різноманітних методів досліджень сьогодні стало можливим вивчення первинної структури понад 2 тис. різних білків. Серед них білок-гормон інсулін, білок-фермент рибонуклеаза та ряд інших. Крім того, вивчено порядок розташування амінокислот у природних пептидів — окситоцину, вазопресину тощо.
Різна будова радикалів амінокислот обумовлює різноманітність білків, а також визначає їх хімічні та біологічні властивості.
2.2.Характеристика вторинної структури білкової молекули
Вторинна структура біополі-меру визначає способи, за якими ланцюги складаються й утримуються у вигляді певних утворень. Відомо, що існує тільки невелика кількість білків, поліпептиди яких перебувають у вигляді лінійних ланцюгів. Використовуючи рентгено-структурні методи дослідження, встановили, що переважна більшість білків має поліпептидні ланцюги, скручені у вигляді спіралі.
Утворення внутрішньомолекулярних водневих зв’язків у глобулярних білках може привести до структури, що називають спіраль. У фібрилярних білках утворення водневих зв’язків може привести до виникнення складчастої листової структури — β-структури. Відомості про ці структури дають право поділити білки на два класи: фібрилярні (від лат.fibra— волокно) та глобулярні (від лат. globulus — кулька). Найвиразніша відмінність між білками обох типів полягає в тому, що фібрилярні білки в основному нерозчинні, а глобулярні — добре розчинні у воді. Тому їх інколи називають «розчинними білками». Вторинна структура властива для таких білків, як фіброїн (білок шовку), кератин (білок сполучної тканини) та деякі інші.
2.3.Характеристика третинної структури білкової молекули
Третинна структура білків — це повна тримірна структура однієї неподільної макромолекули. Під третинною структурою розуміють розташування поліпептидного ланцюга у просторі.
Іншими словами, третинна структура — це укладання вторинних структур поліпептидних ланцюгів з утворенням клубків різної форми.
Найважливіший тип зв’язку третинної структури — ковалентний зв’язок:
за його рахунок утворюються дисульфідні містки між двома цистеїновими залишками одного й того самого поліпептидного ланцюга. Дисульфідні містки можуть утворюватися і між цистеїновими залишками різних білкових ланцюгів, утримуючи разом два ланцюги в стабільній структурі. Також важливу роль в утворенні третинної структури відіграють водневі, гідрофобні та йонні зв’язки.
В утворенні третинної структури беруть участь і так звані сольові містки, утворені кислими функціональними групами одних і основними функціональними групами інших амінокислот. Це можуть бути й прості йонні взаємодії зарядженої групи однієї амінокислоти та протилежно зарядженої групи іншої.
На сьогодні розшифровано третинну структуру понад 10 тис. різних білків. Першою була розшифрована третинна структура білка міоглобіну англійським ученим Кендрю у 1957 р.
Міоглобін — відносно невеликий глобулярний білок (Мг = 16 700); молекула складається з одного поліпептидного ланцюга, в якому міститься 153 амінокислотні залишки. Він слугує не лише для депонування кисню, а й для прискорення його дифузії в клітину. Пептидний ланцюг міоглобіну в спрощеному вигляді нагадує довгу ковбаску надзвичайно химерної форми (див. малюнок). Специфічна структура, яка виникає в результаті такого скручування, і є те, що ми називаємо третинною структурою міоглобіну.
Крім міоглобіну, розшифровано третинна структура таких білків, як гемоглобін, рибонуклеаза, лізоцим, хімотрипсиноген та ін.
2.4.Характеристика четвертинної структури білкової молекули
Четвертинна структура білків є вищим рівнем структурної організації. Вона утворюється завдяки об’єднанню незалежних оди ниць третинної структури в комплекс. Ряд білків складається з двох, чотирьох та більшої кількості індивідуальних поліпептидних ланцюгів.
Такі ланцюги з власною третинною структурою називаються субодиницями. Взаємне просторове розміщення субодиниць у білковій молекулі і становить четвертинну структуру. Більшість глобулярних білків з молекулярною масою, яка перевищує 50 000, — це олігомерні білки, тобто білки, які складаються з двох чи кількох окремих поліпептидних ланцюгів характерний спосіб розміщення в просторі олігомерного білка описується його четвертинною структурою.
Прикладом четвертинної структури є волосся, кожне волокно якого складається з кількох білкових молекул, що мають форму спіралі. Ці молекули, згортаючись одна навколо іншої, утворюють складнішу «суперспіраль».
Класичним прикладом четвертинної структури є гемоглобін — один з небагатьох олігомерних білків, для якого за допомогою рентгеноструктурного аналізу встановлено третинну і четвертинну структури. В утворенні і стабілізації четвертинної структури беруть участь гідрофобні, водневі та йонні зв’язки.
3.Класифікація білків
Білки класифікують за різними ознаками
-За морфологічними ознаками поділяють на фібрилярні та глобулярні
-За фізико-хімічними властивостями на прості та складні
4.Властивості білків
Денатурація
При дії деяких факторів відбувається руйнування тривимірної конформації білка – денатурація, що пов’язане зі зміною вторинної, третинної і четвертинної структур; ця зміна може носити тимчасовий або постійний характер, але в обох випадках амінокислотна послідовність білка залишається незмінною.
Фактори, що зумовлюють денатурацію білка:
-Нагрівання або вплив випромінювань.
-Сильні кислоти, луги, концентровані розчини солей
-Важкі метали.
-Органічні розчинники й детергенти (спирт спричиняє денатурацію білка будь-яких присутніх бактерій).
Іноді денатурований білок за відповідних умов знову спонтанно здобуває вихідну структуру (ренатурація). Даний процес показує, що вторинна і третинна структури білка повністю визначаються його первинною структурою.
Деструкція
Деструкція – порушення первинної структури білка та його розщеплення до амінокислот.
Під впливом мікроорганізмів відбувається гниття білків. Гниття – це розклад, глибоке розщеплення білка з виділенням речовин з неприємним запахом.
5.Функції білків
Будівельна, або структурна. Білки є складовою частиною біологічних мембран. З них складаються структури, які виконують роль скелета клітин.
Головним компонентом хрящів і сухожилків є пружний міцний білок колаген. Волокна, що складаються з цього білка, є у багатьох різновидах сполучної тканини і надають їм міцності. Пружності кісткам надає білок осеїн.
Захисна функція білків полягає у запобіганні пошкодженням клітин, органів, проникненню в організм сторонніх сполук, хвороботворних мікроорганізмів, інших чужорідних тіл. Наприклад, особливі захисні білки — імуноглобуліни, або антитіла, що утворюються в організмі хребетних тварин і людини, здатні «впізнавати» та знешкоджувати бактерії, віруси, чужорідні для організму білки. Білки крові - фібрин, тромбопластин і тромбін — беруть участь у процесах її зсідання, що запобігає великим крововтратам у разі ушкодження стінок кровоносних судин.
Окремі складні білки клітинних мембран, змінюючи свою структуру, передають сигнали із зовнішнього середовища на інші ділянки мембрани або всередину клітини. Так вони здійснюють сигнальну функцію.
Завдяки скоротливій (або руховій) функції білків клітини, тканини, органи або увесь організм можуть змінювати форму, рухатись. Скоротливі білки актин і міозин, які входять до складу м'язових та деяких інших клітин, забезпечують їхню здатність до скорочення. Білок тубулін входить до складу мікротрубочок — компонентів джгутиків і війок певних клітин еукаріотів.
Деякі білки можуть відкладатись у клітинах про запас, тобто виконують запасаючу функцію. Наприклад, білок овальбумін, що накопичується у білковій оболонці пташиних яєць. Його споживає пташеня перед виходом з яйця. В ендоспермі насіння багатьох видів рослин (пшениці, кукурудзи, рису та ін.) відкладаються білки, які споживають зародки під час свого розвитку. Це живильна функція білків.
Одна з основних функцій білків - транспортна. Гемоглобін — дихальний пігмент крові людини, хребетних і багатьох безхребетних тварин - переносить кисень і деяку частку (до 10%) вуглекислого газу. Цим забезпечується газообмін у клітинах і тканинах.
Енергетична функція білків полягає в тому, що за повного розщеплення 1 г білків у середньому звільняється 17,2 кДж енергії.
Деякі білки (гормони білкової природи, ферменти) виконують регуляторну функцію. Вони регулюють активність обміну речовин, процеси росту і розвитку організмів.
Важливою функцією білків є каталітична. Каталіз (від грец. каталіз — припинення) - зміна швидкості перебігу хімічних реакцій під дією певних хімічних сполук. Каталітичну функцію — біокаталіз — у живих організмах виконують ферменти.
6.Узагальнення і закріплення знань
Виконати тестові завдання
Тестові завдання
1. Високомолекулярні біополімери, мономерами яких є залишки -амінокислот це - :
а) ліпіди; б) вуглеводи;
в) білки; г) нуклеїнові кислоти.
2. Процес відновлення природної структури білка після її порушення називають:
а) деструкція; б) денатурація;
в) ренатурація; г) біосинтез.
3. До складу білків входять:
а) замінні амінокислоти; б) незамінні амінокислоти;
в) ліпіди; г) аміногрупи.
4. Амінокислоти, що можуть синтезуватись в організмі людини і тварин з продуктів обміну, називаються:
а) замінні; б) незамінні;
в) білки; г) пептиди.
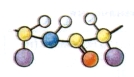 5. Яка структура білка зображена на малюнку:
5. Яка структура білка зображена на малюнку:
а) первина; б) вторинна;
в) третинна; г) четвертинна.
6. Водневі зв’язки підтримують структуру білків:
а) первина; б) вторинна;
в) третинна; г) четвертинна.
7. Амінокислотні залишки сполучаються у поліпептидний ланцюг завдяки:
а) водневим зв’язкам; б) пептидним зв’язкам;
в) гідрофобним взаємодіям; г) дисульфідним зв’язкам.
8. Вторинна структура білків має вигляд:
а) глобули; б) спіралі;
в) декількох глобул, сполучених з небілковим компонентом;
г) ланцюжка сполучених амінокислот.
9. Прискорення біохімічних реакцій в організмі забезпечують:
а) ліпіди; б) алкалоїди;
в) ферменти; г) вуглеводи.
10. Будівельну функцію у клітинні виконують:
а) білки; б) ферменти;
в) ліпіди; г) вуглеводи.
11. Водневі зв’язки підтримують структуру білків:
а) первину; б) вторинну;
в) третинну; г) четвертинну.
12. Активність складних ферментів визначається:
а) їх розташуванням у клітинні;
б) кількістю амінокислотних залишків;
в) просторовою структурою;
г) наявності небілкової частини.
13. Сигнальну функцію білків зумовлює їхня здатність до:
а) деструкції; б) денатурації та ренатурації;
в) розщеплення без участі кисню;
г) утворення тимчасових комплексів з іншими сполуками.
14. Білки входять до складу:
а) клітинних мембран; б) клітинних стінок рослин;
в) черепашок одноклітинних тварин;г) сухожиль.
15. Про яку функцію білка йдеться: забезпечують насичення киснем клітин живих організмів, та виведення вуглекислого газу з них:
а) рухова; б) запасаюча;
в) транспортна; г) регуляторна
7.Підбиття підсумків уроку, рефлексія
Рефлексія
На уроці Я…
– дізнався…
– зрозумів…
– навчився…
– найбільший мій успіх – це…
– найбільші труднощі я відчув…
– я не вмів, а тепер умію…
– я змінив своє ставлення до …
– на наступному уроці я хочу…
8.Інформування учнів про домашнє завдання, інструктаж щодо його виконання.
8.1. Завдання для всього класу
Підручник _______________________________________________________________
8.2. Індивідуальне завдання.


про публікацію авторської розробки
Додати розробку
