Урок "Білки, їхня структурна організація та основні функції"
Дана розробка допоможе вчителям сформувати в учнів загальні уявлення про білки та їхню будову, довести, що білки є основою життя. Сформувати в учнів науковий світогляд про будову та структуру білків та їх роль в організмі людини
Тема: Білки, їхня структурна організація та основні функції
Мета:
Освітня: сформувати в учнів загальні уявлення про білки та їхню будову, довести, що білки є основою життя; формувати у учнів загально навчальні прийоми і способи навчальної діяльності.
Розвиваюча: розвивати інтерес учнів, забезпечити розвиток мисленнєвих операцій ( вміння узагальнювати, робити висновки ), уміння працювати з підручником, уміння індивідуально працювати в групах, та розв’язувати проблеми.
Виховна: сформувати в учнів науковий світогляд про будову та структуру білків та їх роль в організмі людини.
Тип уроку: урок формування вмінь і навичок.
Хід уроку
І. Організаційний етап
ІІ.Мотивація навчальної діяльності
Прийом «Здивуй». На столі викладені такі предмети : шовк, шерсть, яйце, мезим, волосся, горох чи квасоля, пір’я.
Проблемне питання : що об’єднує ці предмети, яка речовина входить до вмісту кожного з них. Так. Це білки. Вони і будуть темою сьогоднішнього уроку. Отже, що є метою нашого уроку. Вивчити особливості будови білків та амінокислот, повторити властивості, розширити і поглибити знання про функції білків в живих організмах.
ІІІ.Вивчення нового матеріалу:
Серед усіх речовин органічної природи білки займають особливе місце — вони становлять основу структури всіх живих систем і виконують ряд важливих функцій.
План
- Білки, їх вміст в організмі, хімічний склад
- Особливості будови молекул білка
- Просторова структура білків
- Властивості білкової молекули: денатурація й ренатурація
- Функції білків
- Білки, їх вміст в організмі, хімічний склад
З якими матеріальними об'єктами пов'язана таємниця життя? Це одне з головних запитань, на яке намагалася дати відповідь наука на протязі своєї історії. І вже досить давно вчені зрозуміли, що найголовнішу роль в усіх життєвих процесах відіграють білки, оскільки вони становлять основну структуру всіх живих систем і виконують ряд важливих функцій.
Ще на початку ХІІІ ст. було встановлено, що речовини, які містяться в соках рослин, екстрактах тваринних тканин, мають однакову природу. Вперше почав вивчати хімію білкових речовин Я. Бекаррі. У 1728 р. він виділів із пшеничного борошна білок-клейковину і дослідив деякі його властивості. У той же час білки вивчав і француз А. Фуркруа. Він ґрунтовно дослідив білки сироватки крові і назвав її три компоненти - желатин, альбулін, фібрин. Пізніше, у 1839 р. галандський хімік Г. Мульдер назвав білки протеїнами (з гр. - перший).
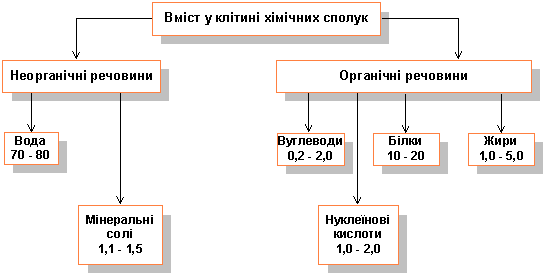
Вміст у клітині хімічних сполук (у відсотках)
Виходячи з аналізу схеми, ми можемо стверджувати, що найбільший %-ий вміст у клітині із даних в схемі хімічних сполук - це вміст білків, які відіграють багато життєво важливих функцій. До складу живих організмів входить 2Ч1018 видів білків, із них 5 млн. - до складу людини і тварин.
Вміст білків в організмі людини:
- у м'язах - 80%,
- в шкірі - 63%,
- в печінці - 57%,
- в кістках - 28%.
Класифікація білків
Склад Будова
Прості Складні Фібрилярні Глобулярні
1. Альбуміни 1.Фосфопротеїди 1.Кератин 1. Альбуміни
2. Глобуліни 2. Ліпопротеїди 2. Калоген 2. Глобуліни
3. Проламіни 3. Нуклєпротеїди 3. Фібрин
4. Протаміни 4. Хромопротеїди
5. Гістони 5. Металопротеїди
6. Глютеліни 6. Глікопротеїди
7. Протеїди
Хімічний склад білків
У 1810 р. вчені Ж. Гей-Люссик і Л. Біснор встановили елементарний склад білків. Вони з'ясували, що до їх складу входять такі елементи: вуглець, водень, кисень, азот, сірка.
За хімічною природою білки - біополімери, мономерами, яких є амінокислоти - відносно низькомолекулярні сполуки. В склад кожної амінокислоти входить карбоксильна група (-СООН), яка надає молекулі кислотних властивостей, аміногрупа (-NH2) надає властивостей основ, які приєднані до одного і того ж атома вуглецю. До цього ж атома вуглецю приєднана і одна із багатьох бокових груп (радикалів - "R").
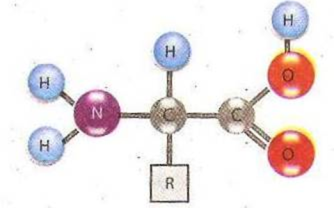
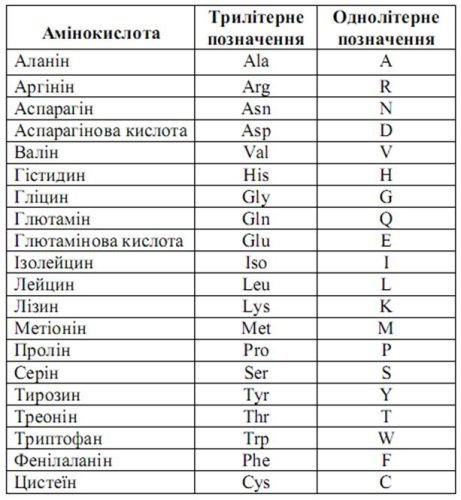
Існує багато тисяч різних білків, проте вся ця різноманітність досягається відповідним поєднанням усього лише 20 амінокислот, які відрізняються одна від одної своїми боковими групами (радикалами).
Амінокислоти поділяють на замінні та незамінні. Замінні амінокислоти можуть синтезуватись в організмі людини і тварини з продуктів обміну речовин.
Незамінні амінокислоти не можуть синтезуватись в організмі в процесі обміну і повинні надходить з рослинною їжею (лізин, триптофан, фенілаланін, мятіонін, треонін, лейцин, ізолейцін, валін).
|
Амінокислоти
|
|
|
Замінні |
Незамінні |
|
Глютамінова кислота, аланін, аспаргін, цистеїн, цистін, гліцин, пролін, серін, тирозин |
Аргінін, гістидин, фенілаланін, ізолейцин, лейцин, лізін, метіонін,треонін, триптофан, валін |
2. Особливості будови молекул білка
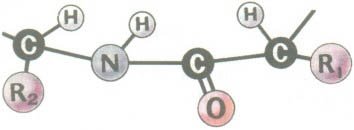
Білки - біополімери, мономерами яких є амінокислоти, які сполучаючись між собою утворюють довгий ланцюг, який називають поліпептидом.
Молекули амінокислот мають здатність з'єднуватись між собою так званими пептидними зв'язками, що виникають внаслідок взаємодії групи -NH2 однієї молекули з групою - СООН другої з виділенням води. Так утворюються лінійні полімери амінокислот - поліпептиди (білки).
Як приклад, розглянемо механізм з'єднання амінокислоти (гліцин) з такою ж амінокислотою (гліцин):
Формула амінокислоти:
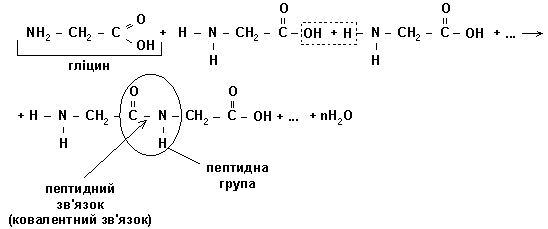
Оскільки під час цієї реакції виділяється певна кількість молекул води - то дану реакцію називають реакцією поліконденсації.
3. Просторова структура білків
Білок - це хімічна індивідуальність, макромолекула з молекулярною масою від 46 (Ммаси спирту) до 500.000 (Ммаси міозину), які розрізняються за:
- складом аміноксилот;
- числом амінокислотних ланочок;
- порядком розташування в ланцюжку.
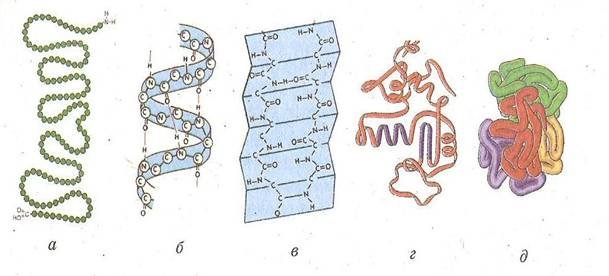
Відомо чотири рівні структурної організації білків: первинна, вторинна, третинна і четвертина
Просторова конфігурація білків
|
Структура білка |
Просторова конфігурація |
|
Первинна |
Послідовне, лінійне сполучення залишків амінокислот за допомогою пептидних зв'язків. Первинна структура представлена у вигляді довгого ланцюга. |
|
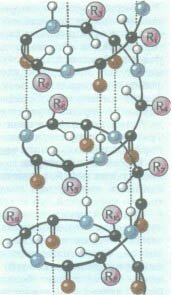
Вторинна |
спосіб упакування первинної структури в альфа-спіраль або бета-шар. Альфа-спіраль виникає в результаті утворення водневих зв`язків між групами -СО- та -NH, розташованих на різних витках спіралі. Бета-шар утворюється в результаті формування водневих зв`язків між СО-групами одного поліпептидного ланцюга та NH-групами іншого поліпептидного ланцюга
|
|
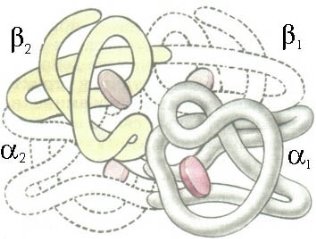
Третинна |
спосіб упакування альфа-спіралі у просторову глобулу. Утворюється завдяки додатковим водневим зв`язкам, гідрофільно-гідрофобним взаємодіям та ковалентним дисульфід ним зв`язкам -S-S-, які виникають між двома молекулами цистеїну |
|
Четвертинна |
спосіб спільного упакування декількох поліпептидних ланцюгів Повну структуру гомоглобіну визначили Кендрю і Перуц. |
Схематична структура білка (первинна)
Схематична структура білка (вторинна)
Схематична структура білка (третинна)

Схематична структура гемоглобину (четвертинна)
Структура гемоглобіну.
(2a-ланцюга і 2b-ланцюга).
З кожним ланцюгом з'єднана одна група гема, до якої приєднується молекула кисню.
4. Властивості білкової молекули: денатурація й ренатурація
Денатурація – втрата природної конфігурації білкової молекули та їнших біополімерів у результаті нагрівання, хімічної обробки. Зумовлюється розривом нековалентних (слабких) зв’язків у молекулі біополімера. Денатурація зумовлена втратою біологічної активності. Може бути повною, частковою, зворотною, незворотною.
Ренатурація – зворотний перехід молекули біополімера, наприклад білка або нуклеїнової кислоти, з денатурованого (неактивного) стану в нативний (біологічно активний).
|
Чинники, які зумовлюють денатурацію білків |
|
|
Хімічні |
Фізичні |
|
|
5.Функції білків
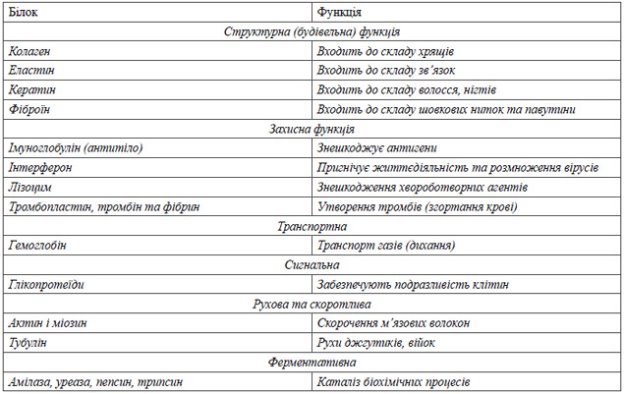
ІV. Узагальнення знань учнів
Визначте, які з наведених тверджень правильні і позначте знаком "+", а які неправильні і позначте знаком "-".
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
- |
+ |
- |
+ |
- |
- |
- |
+ |
+ |
+ |
- Фосфор входить до складу білків.
- Мономерами білків є амінокислоти.
- Вторинну структуру білків стабілізують дисульфідні зв'язки.
- Незамінною амінокислотою в людини є триптофан.
- Спільним для всіх амінокислот є радикал.
- Утворення глобули характерне для вторинної структури білка.
- Для молекули гемоглобіну характерна третинна структура білка.
- Відомих амінокислот, які беруть участь у синтезі білків 20.
- Амінокислоти, які можуть синтезуватись в організмі людини і тварини з продуктів обміну речовин називаються замінні.
- Частина молекул амінокислот яка відрізняє їх одна від одної - радикал.
V. Домашнє завдання


про публікацію авторської розробки
Додати розробку
