Урок Білки: склад і будова, фізичні та хімічні властивості. Значення білків.
Формувати поняття про білки як природні полімери, первинну, вторинну, третинну й четвертинну структури білкових молекул; ознайомити учнів з фізичними й хімічними властивостями білків на прикладі гідролізу й денатурації; показати кольорові реакції білків як якісні реакції на білки.
Вивчення нового матеріалу.
Білки: склад і будова, фізичні та хімічні властивості. Значення білків.

Тема уроку: Білки: склад і будова, фізичні та хімічні властивості. Значення білків.
Мета уроку: формувати поняття про білки як природні полімери, первинну, вторинну, третинну й четвертинну структури білкових молекул; ознайомити учнів з фізичними й хімічними властивостями білків на прикладі гідролізу й денатурації; показати кольорові реакції білків як якісні реакції на білки.
Тип уроку: вивчення нового матеріалу.
Обладнання: комп‘ютери, презентація, демонстрації «Розчинення й осадження білків», «Денатурація білків», лабораторний дослід 14 «Кольорові реакції білків».
Хід уроку
І. Організаційний момент.
ІІ. Актуалізація опорних знань.
Бесіда:
- Які сполуки називають амінокислотами?
- Чому амінокислоти називають амфотерними сполуками?
- Що є продуктом реакції між двома амінокислотами?
- Напишіть схему утворення дипептиду.
- Основою синтезу яких речовин в живих організмах є утворення поліпептидів?
ІІІ. Мотивація навчальної діяльності.
Вчитель хімії. Сьогодні ми ознайомимося із особливостями будови та властивостями органічних речовин, без яких неможливе життя на Землі. Ці сполуки – білки. Їх ще називають протеїнами (від грец. protos – перший, головний).
Проблемне запитання: Чому білки називають протеїнами?

ІV. Повідомлення теми уроку.

V. Вивчення нового матеріалу.
1. Поняття про білки.
Вчитель хімії.
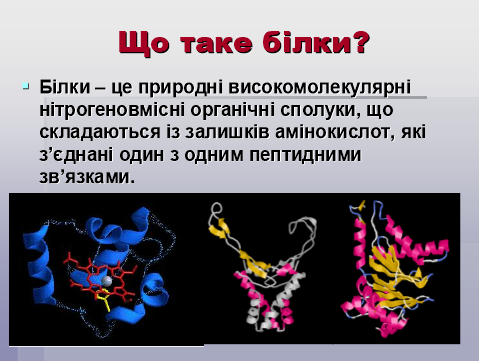
2. Історія вивчення білків.
Вчитель біології.

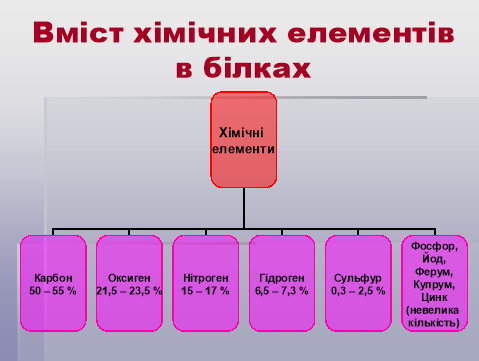
3. Хімічний склад білків.
Вчитель хімії.
Бесіда:
- Які хімічні елементи входять до складу білків?
- Якого хімічного елемента є найбільше у білках?
- Яких елементів порівняно небагато у білках?
Розглянемо ще раз схему утворення пептидного зв‘язку між залишками амінокислот.
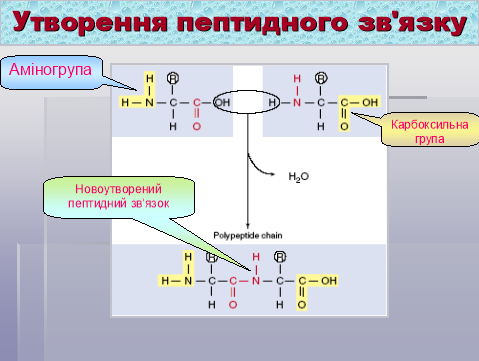
Бесіда:
- Що є мономерами у складі білкових молекул?
- Які функціональні групи приймають участь в утворенні пептидного зв‘язку?
Отже, перетворення мономера у полімер відбувається таким чином:
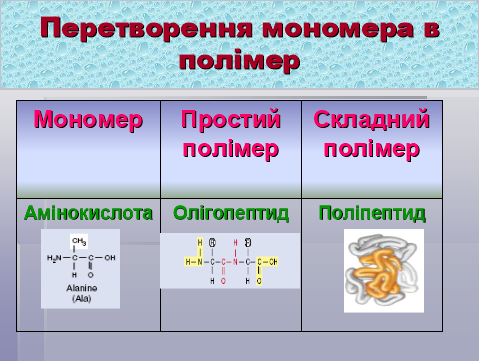
Оскільки білки – це полімери, то вони мають великі значення молекулярних мас: від десятків тисяч до кількох мільйонів.
4. Класифікація білків.
Вчитель біології.
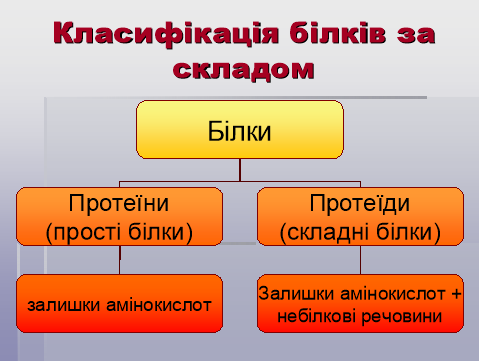
- Просторова будова білкових молекул.
Вчитель хімії.
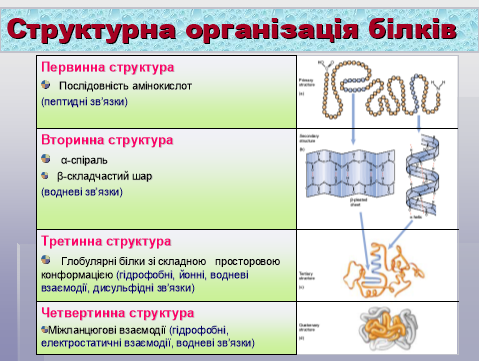
Бесіда:
- Що таке первинна, вторинна, третинна та четвертинна структура білка?
- Якими зв‘язками підтримуються дані структури білка?
- Властивості білків.
Вчитель хімії.
Фізичні властивості білків: не мають температур плавлення і кипіння; частина білків розчиняється у воді з утворенням колоїдних розчинів.
Демонстрація. Розчинення й осадження білків.
Хімічні властивості білків.

Демонстрація. Денатурація білків.

Бесіда:
- Яка структура білка зберігається при його денатурації?
- Чи завжди денатурація є необоротною?
- Як називається процес відновлення структури білка?
- Про що свідчить ренатурація білка?
- Чому деструкція завжди необоротна?
- Прокоментуйте схему денатурації білка.
Білки – амфотерні сполуки зі слабко вираженими основними та кислотними властивостями.
При нагріванні із сильними кислотами або з лугами і під дією ферментів білки зазнають гідролізу (кислотно-основний та ферментативний гідроліз). Гідроліз відбувається в кілька стадій.
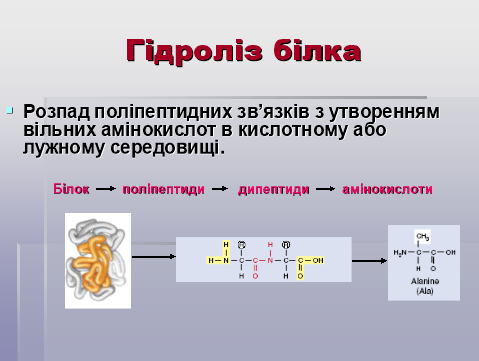
Бесіда:
- Які речовини є кінцевими продуктами гідролізу білків?
- Чи процес гідролізу є одностадійним?
- Чому гідроліз не відбувається в одну стадію?
- Яке значення має гідроліз для засвоєння організмом білкової їжі?
Деякі реакції за участю білків супроводжуються зміною кольору, тому їх називають кольоровими. Вони є якісними реакціями на білки.

Лабораторний дослід 14. Кольорові реакції білків.
- Синтез білків.
Вчитель біології. В останні роки біотехнологія досягнула значних успіхів в процесах штучного синтезу окремих білків. Але живі організми залишаються єдиними біотехнологічними лабораторіями, в яких повністю налагоджено синтез білка. Синтезувати білки безпосередньо з неорганічних речовин здатні лише рослини. У них та деяких бактеріях білки утворюються внаслідок фотосинтезу.
У гетеротрофних організмів біосинтез білка відбувається за участю нуклеїнових кислот із амінокислот, що утворилися в процесі гідролізу спожитих з їжею білків, або синтезованих в організмі.
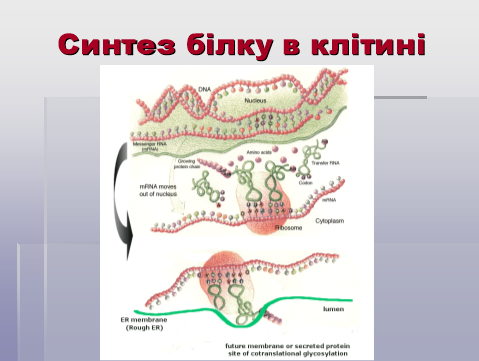
Інформація про структуру білка закодована в генах – ділянках молекул ДНК. Гени знаходяться в ядрі в хромосомах.
І етап: транскрипція – переписування інформації з молекули ДНК на молекулу іРНК.
ІІ етап: трансляція – переведення інформації з молекули іРНК у послідовність амінокислотних залишків молекули білка, що синтезується, на рибосомі.
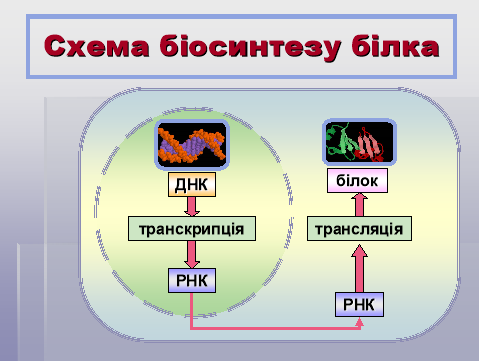
- Значення білків.
Вчитель біології. Значення білків у живій природі визначається їх функціями.

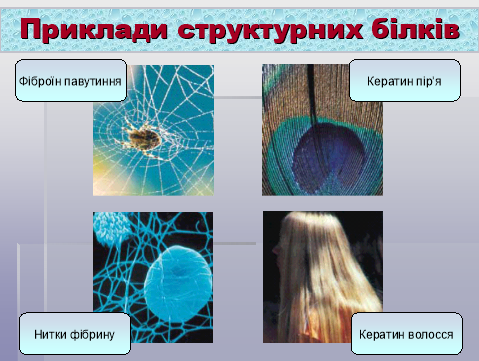
Розглянемо приклади деяких структурних білків.
Вчитель хімії. Білки мають і велике практичне значення.

Отже, ми тепер разом можемо дати відповідь на запитання: Чому білки називають протеїнами?

VІ. Узагальнення знань.
Тестові завдання:
- Який зв‘язок називають пептидним?
а) – СО – О – б) – СО – NН –
в) – СО – NН2 – г) – СООН – NН2 –
- Укажіть найважливішу, на ваш погляд, біологічну функцію білків:
а) каталіз біохімічних процесів;
б) транспорт речовин;
в) регуляція імунної системи живих організмів;
г) забезпечення будівельного матеріалу для тканин.
- Укажіть загальну якісну реакцію на білки й пептиди:
а) ксантопротеїнова реакція;
б) біуретова реакція.
- За яких умов відбувається гідроліз білків?
а) при кип‘ятінні з концентрованою сульфатною кислотою;
б) під дією надлишку лугу;
в) під дією ферментів;
г) при додаванні кип‘яченої води.
- Денатурація білків призводить до руйнування:
а) пептидних зв‘язків;
б) первинної структури;
в) вторинної і третинної структур.
- Яка взаємодія не впливає на формування третинної структури білка?
а) водневі зв‘язки між функціональними групами;
б) гідрофобна взаємодія між вуглеводневими радикалами;
в) дисульфідний зв‘язок;
г) пептидний зв‘язок.
- Первинна структура – це:
а) послідовність амінокислот у білку;
б) амінокислотний склад білка;
в) молекулярна формула білка;
г) будова α-спіралі білка.
- Вторинна структура білка підтримується наявністю в молекулі білка зв‘язків:
а) пептидних; б) водневих; в) дисульфідних.
- Денатурація білка відбувається під дією:
а) води; б) кислот; в) радіації.
VІІ. Домашнє завдання.
Вивчити § 34, вправа 302.


про публікацію авторської розробки
Додати розробку
