Урок: Дослід Резерфорда 9 клас
Урок____ Дата проведення:________________________
Ещё, быть может, каждый атом -
Вселенная, где сто планет;
Там - всё, что здесь, в объеме сжатом,
Но также то, чего здесь нет.
Валерий Брюсов
Тема уроку: . Дослід Резерфорда. Ядерн модель атома.
Тип уроку: засвоєння нових знань, вмінь та навичок.
Мета уроку: ознайомити учнів із класичними уявленнями про будову атома; сформувати уявлення про атом і атомне ядро; ознайомити учнів з дослідом
Резерфорда; формувати світогляд учнів, та зацікавлення предметом; виховувати пізнавальний інтерес.
Метод: засвоєння нових знань, бесіда з елементами демонстрацій.
Обладнання: комп’ютер, проектор, презентація «Будова атома»
Хід уроку:
I. Актуалізація опорних знань.
Провести фронтальне опитування учнів з метою підготовки до сприймання нового матеріалу.
Запитання для організації бесіди.(фронтальне опитування)
- Хто першими висловив припущення про існування атомів? ( Левкіп, Демокріт, Лукрецій Кар.)
- Що таке атом? (найдрібніша, неподільна частинка з якої складається речовина)
- Як людина довідалась про складну будову атома? (Відкриття у 1897р. електрона Дж. Дж. Томсоном)
- Чи були відомі інші частинки крім електрона? (альфа частинки відкриті Беккерелем) – коментар учителя (α-позначення, m α = 8000 me , q+ =2e, v=20000 км\с ? «атом гелію»)
- Які запропоновані моделі атомів ви знаєте? (Ленарда, Дж.Дж. Томсона, У. Томпсона, планетарна модель)
II. Вивчення нового матеріалу.
План уроку
- Мета досліда Резерфорда (короткі відомості біографії Резерфорда)
- Схема установки
3. Інтерпретація досліду Резерфорда
4. Ядерна модель атома
5. Закріплення теми
6. Фізичний диктант
7.Домашнє завдання
III .Постановка проблемних питань.
- Виходячи з оцінки досліду Резерфорда, визначте яка атомна модель на вашу думку найбільш відповідає результатам експерименту.
- Що можна сказати про неподільність атома.
IV. Дослід Резерфорда.
Резерфорд 1906 року запропонував модель, згідно з якою будова атома дуже схожа на будову сонячної системи. Щоб перевірити правильність своєї теорії, він провів низку дослідів, які називають дослідами Резерфорда. Він зондував атоми золота швидкорухомими ядрами гелію (α-частинками).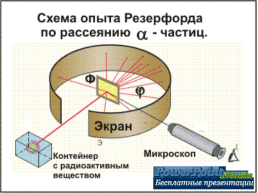 Навпроти отвору в свинцевому контейнері на екрані, покритому ZnSO
Навпроти отвору в свинцевому контейнері на екрані, покритому ZnSO![]() , можна було помітити світлову пляму. Резерфорд помістив на шляху рухомих ядер тонку золоту пластинку (фольгу), і помітив, що лише незначна частина ядер , сцинтиляцій, 132 000 частинок відхилялись на кути до 15 градусів. Лише 33 частинки відхилялись на кути більші за 150 градусів. А з кожних 20 000 частинок, 1 поверталась назад у бік джерела.
, можна було помітити світлову пляму. Резерфорд помістив на шляху рухомих ядер тонку золоту пластинку (фольгу), і помітив, що лише незначна частина ядер , сцинтиляцій, 132 000 частинок відхилялись на кути до 15 градусів. Лише 33 частинки відхилялись на кути більші за 150 градусів. А з кожних 20 000 частинок, 1 поверталась назад у бік джерела.
V. Інтерпретація досліду Резерфорда.
«Поміркувавши, я зрозумів, що це розсіювання назад має бути результатом одиночного зіткнення, і коли я виконав розрахунки,то побачив, що не можливо дістати ефект такого порядку, якщо не вважати, що основна частина маси атома сконцентрована у невеликому ядрі. Саме тоді в мене виникла ідея атома з крихітним важким центром, який несе весь позитивний заряд».
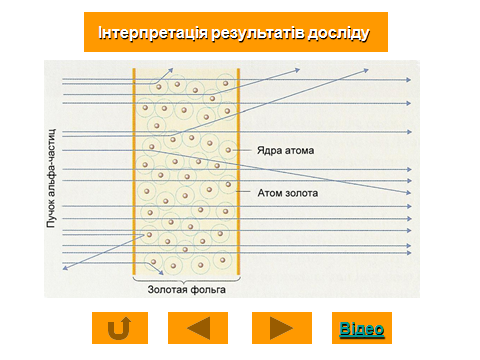
Узагальнивши результати дослідів, Резерфорд зробив висновки: в цілому атом порожній. Майже вся його маса сконцентрована в ядрі діаметром d ~ 10![]() м. Ядро становить 99.95% від маси атома.
м. Ядро становить 99.95% від маси атома.
- ядро несе в собі заряд q+, величина якого за модулем дорівнює заряду електрона, помноженому на порядковий номер цього елемента в таблиці Менделєєва.
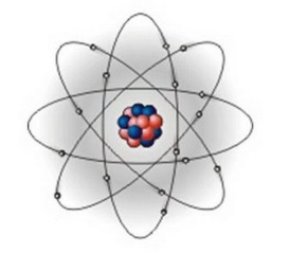
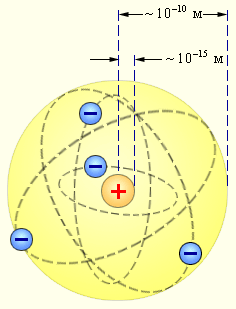
VI. Ядерна модель атома.
Оскільки атом електрично нейтральний, то позитивний заряд ядра компенсує заряд електронів, які мають рухатись навколо ядра, подібно до планет навколо Сонця. Кількість електронів дорівнює порядковому номеру елемента в таблиці Менделєєва. Таку модель атома Резерфорд назвав ядерною моделлю
VII. Закріплення теми.

Запитання до класу: (по слайду)
Які сили утримують електрон на орбіті? •
Як дізнатися про кількість електронів в атомі? •
Що можна сказати про заряд ядра? •
VIII. Фізичний диктант.
1. Хто запропонував першу модель атома? (Дж. Томсон)
2 .Що являє собою перша модель атома? (Позитивно заряджена куля, у якій розташовані електрони)
3. Хто досліджував структуру атома? (Резерфорд)
4. Якими частинками бомбардувалася золота фольга в досліді Резерфорда? (α-частинками)
5 .Як відхилялася більшість частинок, коли проходили крізь фольгу? (Більшість частинок не відхилялася)
6. Чи відхилялися які-небудь частинки на кут більше 90º, пройшовши крізь шар речовини? (Відхилялися, але їх було дуже мало)
7. Якою частинкою може бути відкинута назад α-частинка? (Позитивно зарядженою частинкою великої маси)
8.Я кий заряд має α-частинка? (Позитивний)
9. Чому приблизно дорівнює маса α-частинки? (8000 мас електрона)
10. Із чого складаються молекули? (З атомів)
11. Який знак має заряд ядра? (Позитивний)
12.Я кі частинки рухаються навколо ядра? (Електрони)
IX. Домашнє завдання: §42, Впр. 16 № 3 – 5
10-14м

I. Історія розвитку уявлень про будову атомного ядра.
Усі тіла навколишньої живої й неживої природи складаються з дрібних частинок — атомів: Першими, хто висловив припущення про це, вважаються давньогрецькі філософи Левкіпп і Демокріт. Саме вони назвали атомом дрібну неподільну частинку, що утворює речовину. Вони вважали, що речовини утворюються в результаті зіткнення атомів і появи зв'язків між ними. Ні природу, ні механізм утворення цих зв'язків вони не уточнювали, зате зробили припущення про форму атомів. Вони вважали, що атоми мають форму правильних багатогранників: куба («атоми землі»), тетраедра («атоми вогню»), октаедра («атоми повітря»), ікосаедра («атоми води»).
Більше двадцяти століть знадобилося вченим для того, щоб експериментально підтвердити атомістичну теорію будови речовини. Остаточно ця ідея утвердилася в науці в другій половині дев'ятнадцятого століття. До початку двадцятого століття фізики вже мали досить інформації про масу й розміри атома. На той час стало зрозумілим, що атоми не є дрібними частинками в складі речовини. Вони мають певну внутрішню структуру, розгадка якої дозволила б пояснити періодичність властивостей хімічних елементів. Однак тільки експерименти англійського фізика Ернеста Резерфорда стали основою для створення сучасної протонно-нейтронної моделі атома.
 II. Вивчення нового матеріалу
II. Вивчення нового матеріалу
Як же людина довідалася про складну будову атома? Особливу
 роль у цьому зіграло відкриття в 1897 р. електрона англійським фізиком Джозефом Томсоном. Він установив, що катоди, виготовлені з різних металів, у рентгенівській трубці випускають одні й ті самі заряджені частинки. Сам Томсон назвав їх «корпускули», що в перекладі означає «часточки», і тільки пізніше вони одержали назву «електрон» (назву було взято з робіт англійського фізика Джонстона Стонея).Якщо атом у цілому є електрично
роль у цьому зіграло відкриття в 1897 р. електрона англійським фізиком Джозефом Томсоном. Він установив, що катоди, виготовлені з різних металів, у рентгенівській трубці випускають одні й ті самі заряджені частинки. Сам Томсон назвав їх «корпускули», що в перекладі означає «часточки», і тільки пізніше вони одержали назву «електрон» (назву було взято з робіт англійського фізика Джонстона Стонея).Якщо атом у цілому є електрично
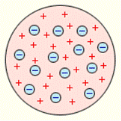
нейтральним, то в ньому повинні міститися й позитивно заряджені частинки. Дж. Томсон запропонував свою модель бу-дови атома, яка одержала назву «пудинг»: роль «родзинок» у такому «пирозі» вико-нують електрони Проте ця модель проіснувала недовго, її було спростовано експериментальними фактами.
Не відразу вчені дійшли правильного розуміння будови атома. Після перших експериментів можна було робити висновки про складну будову атома і наявність в його структурі електричних зарядів. Ці результати отримано М. Фарадеєм 1833 року під час вивчення законів електролізу. 1897 року Дж. Томсон у результаті експериментів з вивчення електричного розряду в розріджених газах явища фотоефекту відкрив електрон. Він виміряв важливу характеристику цієї частинки - питомий заряд q/m=1,76·10![]() Кл/кг.
Кл/кг.
Американський фізик Міллікен 1909 року дуже точно виміряв заряд електрона. Він виявився однаковим у всіх електронів і дорівнює:
e = – 1,6·10![]() Кл.
Кл.
 Маса електрона є приблизно в 2000 разів меншою за масу одного з найлегших атомів - атома водню - і дорівнює m
Маса електрона є приблизно в 2000 разів меншою за масу одного з найлегших атомів - атома водню - і дорівнює m![]() = 9,1·10
= 9,1·10![]() кг. Виходячи з цих даних, Томсон запропонував модель атома, згідно якою атом є зарядженою кулею радіусом R = 10
кг. Виходячи з цих даних, Томсон запропонував модель атома, згідно якою атом є зарядженою кулею радіусом R = 10![]() см, всередині якої знаходяться електрони. Більш складні атоми в додатно зарядженій кулі мають декілька електронів. Таким чином, атом подібний пиріжка, роль родзинок при цьому відіграють електрони.
см, всередині якої знаходяться електрони. Більш складні атоми в додатно зарядженій кулі мають декілька електронів. Таким чином, атом подібний пиріжка, роль родзинок при цьому відіграють електрони.
Однак модель атома Томсона виявилась повністю відмінною від моделі, яку запропонував Резерфорд у результаті своїх досліджень. Резерфорд 1906 року запропонував модель, згідно з якою будова атома дуже схожа на будову сонячної системи. Щоб перевірити правильність своєї теорії, він провів низку дослідів, які називають дослідами Резерфорда .Він зондував атоми золота швидкорухомими ядрами гелію (α-частинками).

Навпроти отвору в свинцевому контейнері на екрані, покритому ZnSO![]() , можна було помітити світлову пляму. Резерфорд помістив на шляху рухомих ядер тонку золоту пластинку (фольгу), і помітив, що лише незначна частина ядер відхиляється на значні кути і дуже мало ядер відбивались назад. Узагальнивши результати дослідів, Резерфорд зробив висновки:
, можна було помітити світлову пляму. Резерфорд помістив на шляху рухомих ядер тонку золоту пластинку (фольгу), і помітив, що лише незначна частина ядер відхиляється на значні кути і дуже мало ядер відбивались назад. Узагальнивши результати дослідів, Резерфорд зробив висновки:
-
 в цілому атом порожній. Майже вся його маса сконцентрована в ядрі діаметром d ~ 10
в цілому атом порожній. Майже вся його маса сконцентрована в ядрі діаметром d ~ 10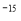 м. Ядро становить 99.95% від маси атома.
м. Ядро становить 99.95% від маси атома.
- ядро несе в собі заряд q+, величина якого за модулем дорівнює заряду електрона, помноженому на порядковий номер цього елемента в таблиці Менделєєва.
- оскільки атом електрично нейтральний, то позитивний заряд ядра компенсує заряд електронів, які мають рухатись навколо ядра, подібно до планет навколо Сонця. Кількість електронів дорівнює порядковому номеру елемента в таблиці Менделєєва. Таку модель атома Резерфорд назвав планетарною моделлю
Запитання до класу
Які сили утримують електрон на орбіті? •
Як дізнатися про кількість електронів в атомі? •
Що можна сказати про заряд ядра? •
ІV. Закріплення нового матеріалу.
Фізичний диктант.
Хто запропонував першу модель атома? (Дж. Томсон)
Що являє собою перша модель атома? (Позитивно заряджена куля, у якій розташовані електрони)
Хто досліджував структуру атома? (Резерфорд)
Якими частинками бомбардувалася золота фольга в досліді Резерфорда? (α-частинками)
Як відхилялася більшість частинок, коли проходили крізь фольгу? (Більшість частинок не відхилялася)
Чи відхилялися які-небудь частинки на кут більше 90º, пройшовши крізь шар речовини? (Відхилялися, але їх було дуже мало)
Якою частинкою може бути відкинута назад α-частинка? (Позитивно зарядженою частинкою великої маси)
Який заряд має α-частинка? (Позитивний)
Чому приблизно дорівнює маса α-частинки? (8000 мас електрона)
Із чого складаються молекули? (З атомів)
Який знак має заряд ядра? (Позитивний)
Які частинки рухаються навколо ядра? (Електрони)
Домашнє завдання: §42, Впр. 16 № 3 - 5


про публікацію авторської розробки
Додати розробку
