Урок "Електролітична дисоціація"
Тема: Електролітична дисоціація.
Мета: сформувати поняття про електролітичну дисоціацію, уявлення про умови утворення та взаємодії йонів у розчині, сформувати поняття про механізм електролітичної дисоціації сполук з іонним та ковалентним полярним зв’язком; сформувати навички запису рівнянь електролітичної дисоціації, виховати в учнів інтерес до знань, комунікативність.
Тип уроку: урок вивчення нового матеріалу.
Основні терміни і поняття: розчини, розчинник, електроліти, неелектроліти, хімічний зв’язок, кристалічна решітка, електролітична дисоціація, катіони, аніони, Йони.
Методи, прийоми і форми роботи: метод «Сніжна грудка», «Встав пропущене» міні – конференція, робота в групах, лабораторне дослідження.
Обладнання: періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності солей, таблиці «Види хімічного зв’язку», портрет Сванте Арреніуса; реактиви : хлорид на кислота, натрій хлорид, лакмус, фенолфталеїн, хімічний посуд.
Очікувані результати навчальних досягнень
Учень
- Знає автора теорії електролітичної дисоціації
- Обґрунтовує суть електричної дисоціаціїі в розчинах
3) може записати рівняння дисоціації кислот, солей, основ
Хід уроку
І. Організаційний момент.(1 хв)
ІІ. Актуалізація опорних знань. (3 хв)
- Метод «Сніжна грудка»
(Алгоритм : слово – речення – питання –відповідь)
наприклад
|
Слово |
Електроліт |
|
Речення |
Речовина, яка проводить електричний струм |
|
Питання |
Які речовини відносяться до електролітів? |
|
Відповідь |
Сильні кислоти, луги, основи |
ІІІ. Оголошення теми та мети уроку. Мотивація навчальної діяльності. (4 хв)
На минулому уроці ми з вами вивчили речовини електроліти та неелектроліти. Сьогодні ми з вами маємо вивчити , як саме, за яким механізмом відбувається проходження електричного струму. Цей процес називається електролітичною дисоціацією.
Пропоную вам самим спрогнозувати, що ви хочете сьогодні вивчити.
(Метод «Мікрофон»)
- Сьогоднішній урок навчить нас…
- На сьогоднішньому уроці я дізнаюся…
- На сьогоднішньому уроці я навчуся …
ІV. Вивчення нового матеріалу.
Розповідь вчителя (3хв)
- Історія відкриття теорії електролітичної дисоціації.
а) Демонстрація портрета автора теорії електролітичної дисоціації та розповідь вчителя.
 Одним з найвидатніших фізико – хіміків 19 – 20 ст був шведський вчений Сванте Август Арреніус. (1859 - 1925 1925рр ).Ще будучи студентом Арреніус зацікавився електролітами електролітами – розчинами, здатними проводити елеке електричний струм.
Одним з найвидатніших фізико – хіміків 19 – 20 ст був шведський вчений Сванте Август Арреніус. (1859 - 1925 1925рр ).Ще будучи студентом Арреніус зацікавився електролітами електролітами – розчинами, здатними проводити елеке електричний струм.
Вперше саме цей вчений припустив, що молекули
розпадаються не на звичайні атоми, а на частинки,
здатні проводити електричний струм.
За допомогою створеної ним теорії йонної дисоціації Арреніус пояснив багато електрохімічних явищ.
б) міні – конференція (4 хв)
(зачитування та обговорення підготовлених коротких доповідей учнями про цікаві факти біографії Сванте Арреніуса).
2. Механізм утворення йоннів при розчиненні речовин з йонним та ковалентно – полярним зв’язком. (Розповідь вчителя)(4 хв)
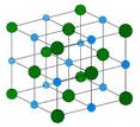
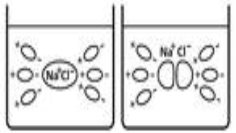
В кристалічних решітках йонних сполук існують вже «готові» і при їх розчинені відбувається процес гідратації, анологічний процесу дисоціації.(На прикладі хлориду натрію)
Цей процес можна описати рівнянням: Na+ +Cl-→NaCl
Процесс дисоціації з ковалентним полярним зв’язком розглянемо на прикладі хлороводню. Молекули води за рахунок взаємодії з атомами Хлору та Гідрогену додатково поляризують зв’язок міх ними. При цьому спільна електронна пара додатково зміщується в бік Хлору, і ковалентний полярний зв’язок перетворюється на йонний.
3.Електролітична дисоціація кислот, основ, солей.
1) робота в групах. (6 хв)
Визначити найбільш полярні зв’язки у молекулах і припустити на які Йони будуть дисоціювати сполуки.
|
І група |
ІІ група |
ІІІ група |
|
|
O - H
|
|
|
K - O
|
O - H
|
H - O
|
(Запис на дошці разом з учнями рівняння дисоціації даних речовин та визначень основ, кислот, солей з точки зору теорії електролітичної дисоціації )
4. Лабораторне дослідження з визначення йонів Гідрогену та гідроксид – йонів у розчинах.(8 хв)
1) Інструктаж з техніки безпеки;
2) Виконання дослідів;
3) Заповнення таблиці результатів;
|
Речовина |
Лакмус |
Фенолфталеїн |
|
Хлоридна кислота |
|
|
|
Натрій гідроксид |
|
|
4) Формулювання висновків.
V. Узагальнення та систематизація знань (3 хв)
1. Метод «Встав пропущене»
- Електролітична дисоціація – це …. розпаду молекул на … (позитивно заряджені … та негативно заряджені …
Кислоти -це речовини, що у водному розчині … на катіони… та аніони …
Основи- це речовини, що у водному розчині … на катіони… та аніони …
Солі - це речовини, що у водному розчині … на катіони… та аніони …
2. Розв’язування тренувальних вправ (5 хв)
Тести (роздатковий матеріал)
1. Які з електролітів дисоціюють у водному розчині з утворенням H+ і OH- одночасно?
а) Са(OH)2 б) Zn(OH)2
в) H3PO4 г) Al(OH)3
2. Які частинки є аніонами?
а) Fe3+ б) NO-3
в) SO42- г) Mn2+
3. Яким елементам відповідають частинки з зарядом -2?
а) Ca б) O в) Fe г) Se
4. Скільки йоннів утворюється при дисоціації (NH4)2SO4?
а) 2 б) 9 в) 3 г) 4
5. Які речовини утворюють при дисоціації йони Mn2+?
а) KMnO4 б) MnCl2
в) Na2MnO4 г) MnO2
VI. Домашнє завдання § 11, Впр 1,2. (1 хв)
VII. Підбиття підсумків уроку. (3 хв)
Рефлексія.
- Чи досягли ми з вами тієї мети, що поставили на початку уроку?
- Що в даній темі виявилось найцікавішим?
- Що в цій теиі вам дається найважче?
- Над якими питаннями ще треба попрацювати?
1


про публікацію авторської розробки
Додати розробку