Урок "Електронні і графічні електронні формули атомів s-, p-, d-елементів. "
Хімія 11 клас тема 1 урок 4
Клас________________ Дата: __________________
УРОК № ______________
Тема: Електронні і графічні електронні формули атомів s-, p-, d-елементів.
Мета: закріпити будову електронних оболонок атомів елементів I-IV періодів; «енергетичні рівні та підрівні», «спін електрона», «спарені», «неспарені електрони», «s-електрони», «р-електрони», «d-електрони»; закріпити вміння користування ПСХЕ; розвивати хімічну мову; виховувати інтерес до вивчання хімії.
Обладнання: презентація, ПС, підручник.
Тип уроку: комбінованований.
Працюємо за підручником: Хімія (рівень стандарту ): підручник для 11 класу закл.заг.серед.освіти/ Олексій Григорович. – Харків: Вид-во «Ранок», 2019 – 224с.: іл.,фот.
Хід уроку
І. ОРГАНІЗАЦІЯ КЛАСУ
- ПЕРЕВІРКА ДОМАШНЬОГО ЗАВДАННЯ
- ОГОЛОШЕННЯ ТЕМИ І МЕТИ УРОКУ
- АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Вправа «Питання-відповідь» Учні працюють в парах. Орієнтовні питання:
- Як можна дізнатися кількість електронів на певному енергетичному рівні?
- Чому дорівнює кількість підрівнів на певному рівні?
- Яка кількість s-електронів, p- та d-електронів може перебувати на певній оболонці?
- Як відбувається заповнення енергетичних рівнів у елементів від Скандію до Цинку?
- ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Розповідь вчителя з елементами бесіди, демонстрація слайдів:
Складемо електронну формулу елемента четвертого періоду - Феруму. Електрони в його атомі перебувають на чотирьох енергетичних рівнях. Скорочена електронна формула атома Феруму в основному стані така: [Ar] 3d64s2. Розподіл електронів за енергетичними рівнями та підрівнями в атомі Феруму схематично зображено на рисунку 1.
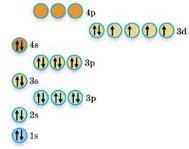
Рис. 1
- УЗАГАЛЬНЕННЯ ЗНАНЬ. РОБОТА В ПАРАХ
Учні виконують завдання парами. Після демонстрації правильних відповідей на дошці обмінюються зошитами з іншою парою учнів та перевіряють їх роботи.
- Замалюйте будову атомів Калію, Ванадію, Галію, Брому (схема, формула, графічне зображення). При заповненні орбіталей урахуйте принцип «мінімальної енергії».
- Скільки енергетичних рівнів містять атоми Кобальту, Германію? Чому? Замалюйте електронну схему розподілу електронів.
- Скільки неспарених електронів містять атоми Хлору та Мангану? Відповідь поясніть на основі будови атомів цих елементів (схема, формула, графічне зображення).
- У чому особливість заповнення енергетичних рівнів у елементів другого ряду четвертого періоду?
- Що таке принцип найменшої енергії? Сформулюйте його.
- У якій послідовності заповнюються орбіталі в елементів 4 періоду за принципом мінімальної енергії?
- ДОМАШНЄ ЗАВДАННЯ
Вивчити §2, впр. 25 стор.12.
- ПІДБИТТЯ ПІДСУМКУ УРОКУ
- РЕФЛЕКСІЯ
Метод «Проаналізуй свою роботу»


про публікацію авторської розробки
Додати розробку
