Урок "Генетичні звязки між основними класами неорганічних сполук"
Конспект уроку з хімії для 11 класу на тему:
«Генетичні зв’язки між основними класами неорганічних сполук».
Підготувала
Вчитель хімії вищої категорії
Теребовлянської ЗОШ І-ІІІ ст. №2
Міхневич Наталія Іванівна
Тема. Генетичні зв’язки між основними класами неорганічних сполук.

Мета: узагальнити й систематизувати знання учнів про неорганічні сполуки;
удосконалювати знання, уміння й навички учнів складати реакції йонного обміну, окисновідновні реакції, розв’язувати задачі на вихід продукту реакції, надлишок і нестачу;
формувати науковий світогляд.
Тип уроку: урок узагальнення й систематизації знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: навчальний семінар.
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів, мультимедійний проектор, ноутбук.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань
ІІІ. Семінар
1. Завдання для фронтальної роботи
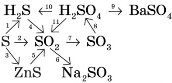
Для реакцій 4, 5, 10, 11 — скласти ОВР, реакції 6, 7, 8, 9 написати в йонно- молекулярній формі.
Варіант І

2. Завдання для групової роботи
Учні об’єднуються в шість-вісім груп, завдання в групах повторюються з метою взаємоперевірки.
1. Обчисліть об’єм карбон(IV) оксиду за н. у., що виділиться в результаті взаємодії 5,3 г натрій карбонату й 8 г сульфатної кислоти.

2. З перелічених речовин виберіть ті, з якими реагуватиме розчин сульфатної кислоти: натрій гідроксид, купрум(II) оксид, золото, магній, барій хлорид, срібло, алюміній гідроксид. Наведіть рівняння реакцій у молекулярній, повній та скороченій йонній формах.
3. До 540 г розчину купрум(II) хлориду долили 560 г розчину натрій гідроксиду з масовою часткою лугу 20 %. Обчисліть масу осаду, що випав, якщо масова частка купрум(II) хлориду становить 20 %.
4. У процесі нагрівання амоній нітриту утворилися азот і вода. Обчисліть об’єм азоту (н. у.), який можна одержати в результаті розкладання 128 г амоній нітриту, якщо об’ємна частка виходу азоту становить 90 %.
1. Обчисліть масу натрій сульфату, що утвориться в результаті зливання двох розчинів, які містять 16 г натрій гідроксиду й 10 г сульфатної кислоти.

2. З перелічених речовин виберіть ті, з якими реагуватиме розчин сульфатної кислоти: кальцій гідроксид, мідь, цинк хлорид, залізо, силіцій(IV) оксид, барій нітрат, купрум(II) гідроксид. Наведіть рівняння реакцій у молекулярній, повній та скороченій йонній формах.
3. Змішали 300 г розчину натрій гідроксиду та 250 г розчину хлоридної кислоти. Обчисліть масу води, що утворилася, якщо до зливання розчини мали однакову масову частку розчиненої речовини — 36 %.
4. У процесі нагрівання 42 г амоній хлориду з надлишком кальцій гідроксиду одержали амоніак об’ємом 11,6 л (н. у.). Обчисліть об’ємну частку виходу амоніаку.
1. У процесі розкладання амоній хлориду масою 107 г одержали амоніак об’ємом 38 л (н. у.). Обчисліть об’ємну частку виходу амоніаку.

2. З перелічених речовин виберіть ті, з якими реагуватиме розчин сульфатної кислоти: літій гідроксид, алюміній, барій хлорид, сульфур(IV) оксид, ферум(III) оксид, мідь, цинк гідроксид. Наведіть рівняння реакцій у молекулярній, повній та скороченій йонній формах.
3. Обчисліть масу осаду, що утвориться в результаті зливання 257 г розчину аргентум нітрату з масовою часткою солі 3,4 % і 364 г розчину хлоридної кислоти з масовою часткою кислоти 2,92 %.
4. Обчисліть масу фосфатної кислоти, яку можна одержати з 200 кг фосфориту, що містить 60 % кальцій фосфату, дією на нього сульфатної кислоти, якщо масова частка виходу кислоти становить 80 %.
IV. Підбиття підсумків уроку
Обговорення підсумків уроку, оцінювання роботи учнів на уроці.
Повторити про неметали та метали.


про публікацію авторської розробки
Додати розробку
