Урок "Горіння і повільне окиснення"
Міністерство освіти і науки України
«Горіння і повільне окиснення»
Мета:
Навчальна:
познайомити учнів з умовами виникнення горіння і припинення, з явищами повільного окиснення. Знати значення цих процесів, вміти аргументувати свою відповідь.
Виховна:
вміти застосовувати свої знання у повсякденному житті, дотримуватись правил техніки безпеки при роботі з вогнем.
Розвиваюча: продовжити формування вмінь і навичок роботи з підручником.
Тип уроку: комбінований
Хід уроку
І. Перевірка домашнього матеріалу:
До дошки - три учня.
1 завдання: скласти формули оксидів
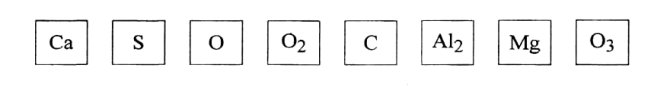
2 завдання: з'єднати речовини так, щоб утворилися формули.
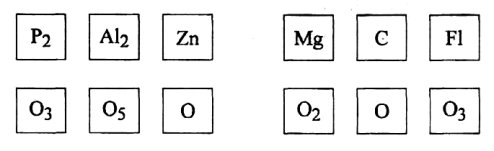
3 завдання: розгадати кросворд
Питання:
- Одиниця вимірювання «кількості речовини».
- Най дрібніша частинка речовини, що зберігає його властивості.
- Цей елемент має в. а. м. 31.
- Складна речовина, що складається з двох елементів, один з яких...
- Це число атомів елементів у формулах речовини.
- Елемент, який має постійну валентність - II.
Робота з класом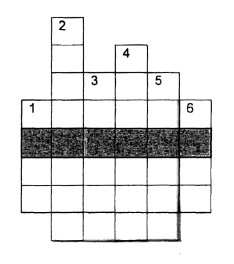 .
.

II. Мотивація нової теми
- Чому починається горіння?
- Що відбувається з речовиною підчас горіння?
- Як можна припинити горіння?
Існує легенда, що коли до міста Сіракуза наблизився ворожий флот, Архімед дав команду усім мешканцям міста принести дзеркала і на правити їх на одну частину корабля. Флот був знищений.
Чому це трапилось?
1. Щоб речовину запалити, необхідно:
- нагріти її до температури займання;
- Забезпечити доступ кисню.
- Чому ж речовина горить? Що підтримує її горіння? Яка значення має горіння в житті людини?
- Як же припинити горіння?
Демонстрація досліду.
Клас розбивається на команди, пропонує свої варіанти припинення горіння.
- загорілася одежа на людині;
- загорілася будівля;
- загорівся телевізор;
- загорівся килим;
- горить вогнище;
- горить ліс;
- горить розлита нафта в океані;
- загорілося у гаражі промаслене ганчір'я.
Після обговорення пропонується вірш:
Газ зусиль не тратить марно,
Все горить у ньому гарно!
Також є він санітаром,
Бо не терпить він сміття.
І рослинне, і тваринне
Обумовлює гниття...
Про що йдеться мова у цьому вірші?
Так, взаємодія речовин з киснем (без горіння) - називається повільним окисленням.
Які приклади повільного окислення ви можете навести.
Буває повільне окислення корисним і шкідливим для людини.
До дошки виходять два учня, один виписує корисні процеси повільного окислення, другий - шкідливі:
- окислення поживних речовин в організмі;
- гниття гною;
- окислення вугілля на шахтах;
- окисання молока;
- темнішає з часом поверхня металів;
- бродіння соку.
Чи може повільне окислення перейти в горіння? Навести приклади.
IIІ. Актуалізація опорних знань
Клас поділяється на групи, кожна група одержує завдання за вивченим матеріалом.
Група 1
1. Розкажіть про поширення Оксигену в природі.
2. Допишіть рівняння реакцій і розставте коефіцієнти:
a) Mg + O2 = б) HgO =
Група 2
1. Розкажіть про будову молекули кисню, його фізичні властивості.
2. Допишіть рівняння реакцій і розставте коефіцієнти:
а) N2 + O2 = б) KNO3 =
Група З
1. Розкажіть про хімічні властивості кисню.
2. Допишіть рівняння реакцій і розставте коефіцієнти:
а) S + O2 = б) КМnO4 =
Група 4
1. Розкажіть про лабораторні способи одержання кисню.
2. Допишіть рівняння реакцій і розставте коефіцієнти:
а) Zn + O2 = б) H2O2 =
Група 5
1. Розкажіть про застосування кисню.
2. Допишіть рівняння реакцій і розставте коефіцієнти:
а)Р + О2 = б)Н2О =
Один представник кожної групи усно відповідає на теоретичне запитання, другий записує рівняння реакції у вигляді стовпчика: реакції сполуки, реакції розкладу.
IV. Поглиблення знань
На дошці записані два стовпчики хімічних рівнянь. Один стовпчик характеризує способи одержання кисню (учні визначають, який саме), другий — хімічні властивості кисню.
• Як називаються продукти горіння простих речовин у кисні? (Оксиди)
•. Назвіть оксиди, записані на дошці. (Учні по черзі називають оксиди.)
• А чи можуть горіти складні речовини? (Так, наприклад, папір, тканина, бензин, природний газ. Природний газ містить складну речовину метан СН4. Під час горіння утворюються два оксиди:
СН2+2О2->СО2 + 2Н2О)
Висновок. Кожен елемент, що входить до складу складної речовини, утворює оксид.
• В якому випадку горіння відбувається швидше: у чистому кисні чи на повітрі? (У чистому кисні)
А без доступу повітря горіння неможливе взагалі.
• Папір добре горить. А чому наші зошити не загоряються зараз? (Необхідно внести їх у вогонь, тобто нагріти. Для кожної речовини існує температура, за якої вона загоряється, наприклад, для дерева ця температура становить близько 270 °С, для вуглецю — 350 °С, для білого фосфору — близько 40 °С, для азоту — близько 2500 °С)
Така температура називається температурою загоряння.
• Отже, які умови мають виконуватися для виникнення горіння? (Нагрівання речовини до температури загоряння і наявність кисню)
• А як зупинити процес горіння? (Перекрити доступ кисню. Остудити речовину до температури, нижчої за температуру загоряння)
• Які засоби гасіння пожеж ви знаєте? (Вогнегасники; пісок; вода та ін.)
Деякі речовини можуть повільно окиснюватися під впливом повітря без температури загоряння. Наприклад, залізо іржавіє, срібло вкривається сірим нальотом. Такий процес називають мимовільним окисненням.
V. Закріплення вивченого матеріалу
Завдання 1. Складіть рівняння горіння запропонованих нижче речовин і розставте коефіцієнти:
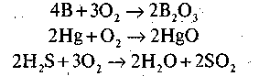
Завдання 2. Обчисліть масові частки Оксигену в одержаних оксидах і , розташуйте їх у порядку зростання масової частки Оксигену.
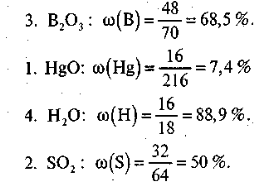
- Що таке горіння?
- Які ви знаєте умови виникнення і припинення горіння?
- Чим повільне окислення відрізняється від горіння? Чим схоже?
VI. Підбиття підсумків
Сьогодні ми дізналися, що реакцією горіння можна керувати. У кожної речовини є температура загоряння. Наприклад, дляNa або Р вона дуже низька, ці речовини називаються легкозаймистими й повинні зберігатися у відповідних умовах відповідно до правил техніки безпеки.
Підбиваємо підсумки уроку. Виставляємо оцінки.
VII. Домашнє завдання
Прочитати параграф, відповісти на запитання, повторити фізичні та хімічні властивості кисню.
Творче завдання. Підготувати повідомлення про кругообіг Оксигену в природі, використання кисню та його біологічну роль.


про публікацію авторської розробки
Додати розробку
