Урок хімії 9 клас "Швидкість хімічної реакції. Чиннико, що впливають на швидкість хімічної реакції"
Урок хімії 9 клас
Тема: Швидкість хімічної реакції. Чинники, що впливають на швидкість хімічної реакції.
Мета: сформувати уявлення про швидкість хімічної реакції, її залежність від різних чинників; вміти аналізувати інформацію, порівнювати, класифікувати, формулювати узагальнювати висновки, застосовувати набуті знання на практиці та оцінювати результати виконаних дій. Розвивати вміння встановлювати причинно – наслідкові зв’язки; виховувати самостійність, удосконалювати навички виконання експерименту з дотримуванням правил техніки безпеки
Обладнання: мультимедійна презентація уроку, відео досліди, роздаткові картки для лабораторного досліду.
Для лабораторного досліду: 1) гранули Zu, Fe, Cu однакового розміру, розведений розчин хлоридної кислоти (HCl), концентрований розчин хлоридної кислоти, шматок крейди, порошок крейди, відеодослід «Вплив каталізатора на швидкість реакції»
Хід уроку
І. Організаційний етап
Психологічна розминка.
Щоб ефективніше організувати нашу роботу на сьогоднішньому уроці, визначимо емоційний стан кожного з нас та цілого класу.
Для цього підніміть смайлики, які є у вас на столах
ІІ. Мотивація.
Вчитель: Сучасний світ уявити без продуктів хімічної промисловості практично неможливо. Будь-яке хімічне виробництво базується на певних хімічних реакціях. Закони економіки диктують необхідність розробки технологій дешевших, економічніших, з максимальним виходом продукту та найменшими витратами.
Складемо асоціативний кущ до поняття « хімічне виробництво»:
tº
умови ↖ ↥ ↗ продукція
сировина ← Хімічне виробництво → інженери
апарати ↙ ↘екологія
Ми бачимо, яке багатогранне поняття «хімічне виробництво». І для того, щоб керувати хімічними процесами, треба знати закономірності протікання хімічних реакцій, умови, що впливають на їх проходження
1. Гра «Вірю – не вірю»
Учні зачитують твердження і дають відповідь - вірне воно чи хибне.
- Екзотермічні реакції відбуваються із виділенням теплоти. (Так)
- Ендотермічні реакції відбуваються із поглинанням теплоти. (Так)
- Реакція горіння вугілля – це ендотермічна реакція. (Ні)
- Тепловий ефект реакції – це маса продукту реакції, що утворилася під час горіння речовини. (Ні)
- Тепловий ефект реакції вимірюється в паскалях (Па), або кілопаскалях(кПа). (Ні)
- Тепловий ефект реакції позначається буквою Q або ∆Н. (Так)
- В ендотермічних реакціях внутрішня енергія речовин зростає. (Так)
- Тепловий ефект реакції – це кількість теплоти, що виділяється, або поглинається під час реакції. (Так)
- Тепловий ефект реакції вимірюється в Дж або кДж. (Так)
- Хімічні рівняння, в яких зазначаються ступені окиснення елементів, називаються термохімічними. (Ні)
- При екзотермічних реакціях температура реакційної системи підвищується. (Так)
12.Під час протікання ендотермічної реакції температура реакційної суміші підвищується. (Ні)
2. Повторення вивченого
1. Що таке «Хімічна реакція » ? (це перетворення одних речовин на інші при незмінності ядер атомів)
2. Які ознаки протікання хімічної реакції ? (Виділення або поглинання тепла, світла,електричної енергії ; поява або зникнення запаху , виділення газу , випадання осаду та інше)
3. Назвіть вам відомі типи реакцій ? (розклад, обмін, оборотні, необоротні, екзотермічні, ендотермічні, окисно-відновні, йонного обмінну, каталітичні, не каталітичні )
3. Повільно чи швидко
- Ржавіння заліза \повільно
- Утворення мінералів у земній корі \ повільно
- Твердіння цементу \повільно
- Вибух пороху \швидко
- Спалах пари бензину в двигуні \швидко
А зараз переходимо до вивчення нової теми. Почнемо з питання: чим відрізняється черепаха від гепарда? (швидкість руху).
Чим відрізняється повільне окиснення від вибуху? (швидкість реакції). Саме про швидкість хімічної реакції буде йти мова на сьогоднішньому уроці.
Епіграфом уроку є вислів Бернарда Шоу «Єдиний шлях до знань - діяльність»
ІІІ. Вивчення нового матеріалу.
- Вивчаючи хімічні властивості різних сполук, ви напевне звернули увагу на те, що для перебігу різних реакцій потрібний різний час:
- Іржа на залізних виробах утворюється за кілька місяців;
- Горіння свічки триває кілька годин;
- Реакція між содою і оцтом відбувається в одну мить.
- Отже, реакції перебігають з різною швидкістю. Пригадайте, як на уроках фізики і математики, ви позначали швидкість руху? (U)
- Швидкість хімічних реакцій вивчає розділ хімії, що називається (хімічною кінетикою.)
- За якими критеріями можна судити про швидкість протікання хімічної реакції?
(За зміною кількості вихідних речовин і продуктів реакції.)
Швидкість хімічної реакції оцінюють, виходячи зі зміни кількості частинок (концентрації - С) речовини реагенту чи продукту реакції за одиницю часу.
Коли у рівнянні швидкості хімічної реакції враховуються зміни кількості частинок реагуючих речовин, у його правій частині ставлять знак «-», тому що кількість частинок цих речовин зменшується.
Якщо початкова кількість частинок речовини позначити С1, а через деякий час t – C2, то швидкість реакції можна зобразити так:
![]()
Коли в рівнянні враховується зміна кількості частинок речовин, які утворилися у правій частині ставлять знак «+»
![]()
швидкість хімічної реакції визначається зміною концентрації однієї з речовин, що реагують, за одиницю часу.
Задача: Початкова концентрація сульфур (ІV) оксиду в реакції окиснення його до сульфур (VІ) оксиду була 3 моль/л, а через 50 с стала 0,5 моль/л.
Розташуйте явища за зростанням швидкості хімічних реакцій:
|
Явища |
Очікуванні відповіді |
|
|
- В житті часто виникає потреба керувати швидкістю реакції . Наприклад,
- горіння палива прискорювати;
- пожежу – сповільнювати;
- іржавіння заліза сповільнювати.
Для цього потрібно знати від чого залежить швидкість реакції.
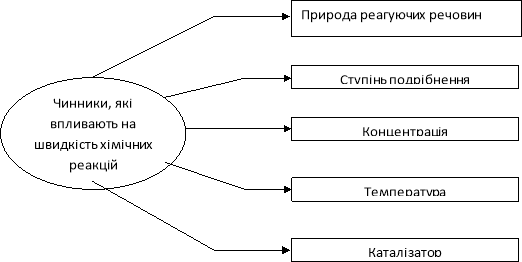
2. Чинники, які впливають на стан хімічної рівноваги:
Пригадайте й неухильно виконуйте ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ
Забороняється:
- Брати реактиви руками і куштувати їх на смак;
- Набирати однією і тією ж ложкою (шпателем) різні реактиви;
- Залишати відкритим посуд від реактивів;
- Виконувати досліди, непередбачені інструкцією;
- Залишати неприбраним робоче місце;
- Зливати або зсипати реактиви в раковину
Клас ділиться на групи. Кожна група виконує дослід і записує результат у таблицю.
І група Залежність швидкості реакції від різних чинників.
Мета: дослідити вплив різних чинників на швидкість хімічної реакції.
Обладнання: гранули Zu, Mg, Cu , розведений розчин хлоридної кислоти (HCl), концентрований розчин хлоридної кислоти, шматок крейди, порошок крейди, спиртівка, сірники, тримач.
Дослід 1. Вплив природи реагуючих речовин на швидкість хімічної реакції.
В три пробірки киньте гранулу міді, цинку, магнію. В кожну пробірку долийте розчин хлоридної кислоти. Зробіть висновок, як впливає природа реагуючих речовин на швидкість реакції. Результати спостереження запишіть в таблиці.
ІІ група: Вплив площі поверхні стикання речовин на швидкість хімічної реакції.
В одну пробірку киньте шматочок крейди, а в іншу пробірку насипте стільки ж порошку крейди. В кожну пробірку долийте розчин хлоридної кислоти. Зробіть висновок, як ступінь подрібнення речовин впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
ІІІ група Вплив концентрації речовин на швидкість хімічної реакції
В дві пробірки киньте однакові гранули цинку. В першу пробірку налийте розведений розчин хлоридної кислоти, а в другу – концентрований розчин хлоридної кислоти. Зробіть висновки, як концентрація речовин впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
ІV група: Вплив температури на швидкість реакції
В дві пробірки киньте однакові гранули цинку. В кожну пробірку долийте розчин хлоридної кислоти. Одну з пробірок підігрійте в полум’ї спиртівки. Зробіть висновок, як температура впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
|
Фактори, які впливають на швидкість реакції |
Хімічний експеримент, спостереження |
Висновок |
|
Природа реагуючих речовин |
Zn + 2HCl → ZnCl2 + H2 – відбувається швидко Fe+ 2HCl → FeCl2 + H2 – відбувається повільно |
Чим активніша речовина, яка вступає в реакцію, тим швидше відбувається реакція |
|
Ступінь подрібнення речовини |
СаСО3 шматок + 2HСl → CaCl2 + CO2 + H2O реакція відбувається повільно
СаСО3 порошок + 2HСl → CaCl2 + CO2 + H2O реакція відбувається швидко |
Чим більша поверхня стикання реагентів, тим більша швидкість реакції |
|
Концентрація реагуючих речовин. |
Zn + 2HClрозвед. → ZnCl2 + H2 – відбувається повільно
Zn + 2HCl концентр. → ZnCl2 + H2 – відбувається швидко |
Чим більша концентрація реагуючих речовин, тим швидше відбувається реакція. |
|
Температура |
Zn + 2HCl → ZnCl2 + H2 – відбувається повільно t Zn + 2HCl. → ZnCl2 + H2 – відбувається швидко |
При нагріванні швидкість реакції зростає. |
|
Наявність каталізатора або інгібітора |
Відео
Відео досліди: MnO2 2Н2О2 → 2Н2О + О2
H2O 2Al + 3I2 → 2AlI3 |
Каталізатори – прискорюють швидкість реакції Інгібітори - сповільнюють швидкість реакції
|
ІV. Узагальнення і систематизація знань.
Використай свої знання про швидкість реакції в побуті:
- Чому продукти харчування зберігають в холодильнику?
- Під час консервації продуктів використовують речовини – консерванти. Яку іншу назву можна дати цим речовинам?
- Встановіть відповідність
|
А.Зі зростанням температури швидкість реакції збільшується. |
|
2.Аби пришвидшити випалювання залізної руди, її подрібнюють і розпорошують. |
Б.Зі зменшенням концентрації реагентів швидкість реакції зменшується. |
|
3.Улітку зростає небезпека харчових отруєнь. |
В.Зі зростанням площі поверхні контакту реагентів швидкість реакції зростає. |
|
4.Термін служби мідних водопровідних труб значно більший порівняно зі сталевими. |
Г.Каталізатори пришвидшують хімічні реакції. |
|
|
Д.Швидкість реакції залежить від природи реагентів. |
Домашнє завдання
Виставлення оцінок


про публікацію авторської розробки
Додати розробку
