Урок хімії " Кристалічні гратки"
Тема. Кристалічні гратки. Атомні, молекулярні та йонні кристали.
Мета: ознайомити учнів з типами кристалічних ґраток (атомною, молекулярною, йонною, металевою); показати взаємозв'язок між будовою речовин та їх фізичними властивостями на підставі знань про типи хімічних зв'язків у неорганічних речовинах, сформувати вміння характеризувати фізичні властивості речовин за типом кристалічних ґраток і видом хімічного зв'язку;
розвивати логічне мислення та усне мовлення, уміння аналізувати, зіставляти, робити висновки;
виховувати любов до предмету, самостійність та творчий підхід.
Державні вимоги до рівня загальноосвітньої підготовки учнів: Учень:
-називає типи кристалічних ґраток;
-наводить приклади сполук із атомними, молекулярними та йонними кристалічними ґратками;
-характеризує особливості кристалічної будови речовин з різними видами хімічного зв’язку;
-обґрунтовує фізичні властивості речовин залежно від їхньої будови;
-прогнозує властивості речовин залежно від виду хімічного зв’язку і типу кристалічних ґраток;
Обладнання та реактиви: Періодична система хімічних елементів Д. І. Менделеева, таблиця електронегативностей, види кристалічних ґраток, ватман, маркери.
Базові поняття і терміни:хімічний зв’язок, електронегативність, ковалентний зв’язок, йонний зв’язок, кристалічні гратки, атомна, молекулярна, йонна.
Тип уроку: засвоєння нових знань.
Хід уроку
І. Організаційний момент.
ІІ. Мотивація навчальної діяльності.
Сьогодні ми з вами поринемо у світ молекулярної хімії, вивчаючи будову речовини, з’ясуємо яка залежність існує між будовою і хімічними властивостями речовини.
ІІІ. Актуалізація опорних знань.
1.Заповнити схему:
2. Вправа « Асоціація».
ІV. Вивчення нового матеріалу.
- Розповідь вчителя( складання схеми учнями в зошитах)
Розрізняють два стани твердих речовин - кристалічний і аморфний.

 Будова твердих речовин
Будова твердих речовин
Аморфна Кристалічна
Структурні частинки Структурні частинки
речовини розміщуються речовини розміщуються
безладно впорядковано
глина кухонна сіль
Кристалічний стан характеризується впорядкованою структурою.
Упорядкованість у кристалах зумовлюється правильним геометричним розташуванням частинок, з яких складається тверда речовина. Кожна кристалічна речовина має певну, характерну форму. Кристалики кухонної солі мають форму куба, калійної селітри — форму призми, алюмінієвих квасців — форму октаедрів і т.д.
Аморфні речовини не утворюють правильної геометричної структури і складаються із невпорядковано розташованих молекул. На відміну від кристалічних речовин, що мають певну температуру плавлення, аморфні речовини плавляться в широкому інтервалі температур. При нагріванні вони поступово розм'якшуються, потім починають розтікатися, нарешті, стають рідкими. Іноді аморфні речовини розглядають, як рідини з дуже великою в'язкістю. Іншими словами, на відміну від кристалічних речовин, що характеризуються далеким порядком, тобто правильною провторюванністю розташування атомів на великих відстанях, аморфні подібно до рідин, мають тільки ближній порядок. Прикладами аморфних речовин можуть бути скло і смола. Деякі речовини можуть перебувати як у кристалічному, так і в аморфному станах, - наприклад, сульфур, силіцид (ІV) оксид та ін.
Багато речовин можуть бути переведені з аморфного стану в кристалічний і навпаки. Так, аморфне скло після витримки при певній температурі "розсолюється", тобто в ньому з'являються дрібні кристалики і скло мутніє. Аморфні речовини сильно відрізняються від кристалічних за своїми фізичними властивостями. Переважна більшість твердих речовин має кристалічну будову.
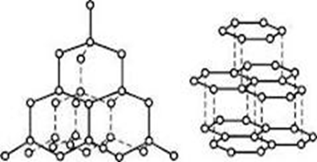
Кристали, розміщені в просторі в певному порядку й утворюють просторову кристалічну решітку. Звичайно на малюнках частини в кристалічній решітці з'єднаються уявними лініями. Кристалічна решітка побудована в умовних однакових структурних одиницях, індивідуальних для кожного кристала. Така структурна одиниця називається елементарною ячейкою. Усього існує 14 типів кристалічних решіток (куб, призма, октаедр і т.д.).
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Структурну впорядкованість кристалічних речовин називають кристалічними гратками.
- Робота учнів в групах ( додаток 1). Створення кластерів.
( Тип кристалічної гратки для групи учні можуть визначити шляхом жеребкування)
Група 1. Іонна кристалічна гратка.
Група 2. Атомна кристалічна гратка.
Група 3. Молекулярна кристалічна гратка.
Група 4. Металічна кристалічна гратка.
Користуючись підручником, гаджетами, додатковою літературою учні груп готують інформацію про тип кристалічної гратки.
Класифікація кристалічних ґраток.
(Учні заповнюють таблицю в зошиті)
|
Тип кристалічної гратки |
Тип хімічного зв’язку |
Фізичні властивості |
Приклади речовин |
|
|
|
|
|
Залежно від природи частинок, що містяться у вузлах кристалічної гратки, і від того, які сили взаємодії між ними переважають розрізняють атомні, йонні, металічні та молекулярні кристалічні гратки.
Демонстрація. Моделі кристалічних ґраток різних типів.
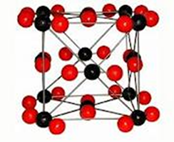
1) Натрій хлорид (NaCl) – твердий, кристалічний, тугоплавкий, добре розчинний у воді.
Хімічний зв’язок - йонний, у вузлах кристалічних ґраток знаходяться йони Натрію і Хлору, які утримуються силами кулонівського притягання.
Такий тип кристалічної ґратки - йонний.
2) Графіт (C)- тверда речовина, нерозчинна у воді.
Хімічний зв'язок - ковалентний неполярний.
Тип кристалічної ґратки - атомна, у вузлах кристалічних ґраток знаходяться атоми Карбону, зв’язані між собою ковалентним полярним зв’язком.
3) Карбон (IV) оксид (CO2) - за н.у. газ, низькі температури плавлення, розчинний у воді.
Хімічний зв’язок - ковалентний полярний.
Тип кристалічної решітки – молекулярна, в вузлах кристалічних ґраток знаходяться молекули вуглекислого газу.
Зв'язок між ними - міжмолекулярна взаємодія.
На прикладі води, можна добре побачити міжмолекулярну взаємодію, молекули води, які знаходяться в вузлах кристалічної решітки сильно притягуються між собою. Таке явище часто спостерігається в природі, наприклад: рух води по ксилемі.
4) Залізо – тверда речовина, високі температури плавлення, нерозчинна у воді.
Хімічний зв'язок – металічний
Тип кристалічної ґратки – металічний, у вузлах кристалічних ґраток знаходяться атоми та Йони Феруму, а між вузлами рухаються вільні електрони.
Інструкція з визначення типу кристалічної ґратки
Визначити до якої групи відноситься дана речовина:
1. Проста речовина – визначити метал чи неметал:
Ме – мають металічну кристалічну гратку;
неМе – мають молекулярну кристалічну гратку;
винятки – деякі неМе мають атомну кристалічну гратку.
2. Складна речовина – визначити клас речовини:
неМехОу – молекулярну кристалічну гратку; P2O5
МехОу – йонну кристалічну гратку; Al2O3
Ме(ОН)х – йонну кристалічну гратку; Cu(OH)2
НхAn – йонну кристалічну гратку; H2SO4
MeхAnу – йонну кристалічну гратку. Na2SO4
V. Узагальнення і систематизація знань.
Завдання 1. За зразками кристалічних ґраток, з’ясувати, яку речовину ви отримали, довести це, заповнюючи таблицю:
Речовини: графіт, алмаз, кухонна сіль, метал, вода.
|
Речовина |
Вид хімічного зв’язку |
Тип кристалічних ґраток |
Структурні частинки |
Фізичні властивості |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Завдання 2. Виправити помилки:
Атомна кристалічна гратка: Cl2, Fe, N2, H2O, C
Молекулярна кристалічна гратка: H2O, KCl, O2, CO2, Au
Металічна кристалічна гратка: Cu, Na, Cl, Fe, Al, H2, SiO2
Йонна кристалічна гратка: NaCl ,CaCl2, Br2, NaBr, SO2
VІ. Підведення підсумків уроку.
Самооцінювання. Трихвилинна пауза
Учитель надає учням трихвилинну паузу, яка дає можливість учням обдумувати поняття, ідеї уроку, пов’язати з попереднім матеріалом, знаннями, досвідом, а також визначитися із незрозумілими моментами.
• Я змінив/змінила своє ставлення до….
• Я дізнався/дізналася більше про….
• Я здивувався/здивувалася тому, що… •
Я відчув/відчула…
VІІ. Домашнє завдання.
Опрацювати параграф підручника.
Знайти цікаві данні про кристалічні гратки різних речовин та використання цих речовин у побуті.
Додаток 1.
Лист самооцінки роботи в групі
Прізвище: _____________________________________
(Оцініть себе за кожним напрямом від 0 до 2 балів)
|
1 |
Ти брав активну участь в роботі групи |
|
|
2 |
Ти вносив вдалі пропозиції, які врахувала група |
|
|
3 |
Ти надав підтримку іншим членам групи, заохочував їх до роботи |
|
|
4 |
Ти висунув цілком нову ідею, що сподобалась іншим |
|
|
5 |
Ти вдало узагальнював думки інших і просував роботу групи вперед |
|
|
6 |
Ти доповідав класу про результати групової роботи |
|
|
|
Всього балів: |
|
Додаток 2.
Кристалічні решітки, що складаються з іонів, називаються іонними. їх утворюють речовини з іонними зв’язками. Прикладом може бути кристал хлориду натрію, в якому, як уже зазначалося, кожен іон натрію оточений шістьма хлорид-іонами, а кожен хлорид-іон – шістьма іонами натрію.
Такому розміщенню відповідає найщільніша упаковка, якщо іони уявити у вигляді куль, розміщених у кристалі.
Число найближчих сусідніх частинок, які щільно приєднуються до даної частинки в кристалі або в окремій молекулі, називається координаційним числом.
У решітці хлориду натрію координаційні числа обох іонів дорівнюють 6. Отже, в кристалі хлориду натрію неможливо виділити окремі молекули солі. їх немає. Весь кристал слід розглядати як гігантськумакромолекулу, що складається з однакового числа іонів Na+ і Сl – , NanCln, де n – велике число. Зв’язки між іонами у такому кристалі досить міцні. Тому речовини з іонною решіткою мають порівняно високу твердість. Сили міжіонної взаємодії є досить значними, тому речовини з таким типом кристалічної гратки є нелеткими, твердими, тугоплавкими, їх розчини та розплави проводять електричний струм. Типовими представниками таких сполук є солі, наприклад, натрій хлорид, калій нітрат та інші.
Плавлення іонних кристалів спричиняє до порушення геометрично правильної орієнтації іонів один відносно одного і зменшення міцності зв’язку між ними. Тому їх розплави проводять електричний струм. Іонні сполуки, як правило, легко розчиняються в рідинах, що складаються з полярних молекул, наприклад у воді.
Додаток 3.
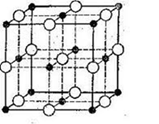
Кристалічні решітки, у вузлах яких розміщуються окремі атоми, називаються атомними. Атоми в таких решітках сполучені між собою міцними ковалентними зв’язками. Прикладом може бути алмаз – одна з модифікацій карбону. Алмаз складається з атомів карбону, кожен з яких зв’язаний з чотирма сусідніми атомами. Координаційне число карбону в алмазі – 4. У решітці алмазу, як і в решітці хлориду натрію, молекул немає. Весь кристал слід розглядати як гігантську молекулу. В неорганічній хімії відома значна кількість речовин з атомною кристалічною решіткою. Вони мають високі температури плавлення (для алмазу понад З 500°С), міцні й тверді, практично не розчинні у рідинах. Атомна кристалічна решітка характерна для твердого бору, кремнію, германію і сполук деяких елементів з карбоном та силіцієм.
Додаток 4.
Кристалічні решітки, що складаються з молекул (полярних і неполярних), називаються молекулярними. Молекули в таких решітках з’єднані між собою порівняно слабкими міжмолекулярними силами. У вузлах молекулярних кристалічних ґраток перебувають молекули речовин із неполярним чи полярним ковалентним зв'язками. Тому речовини з молекулярною решіткою мають малу твердість і низькі температури плавлення, нерозчинні або малорозчинні у воді, їх розчини майже не проводять електричного струму. Число неорганічних речовин з молекулярною решіткою незначне. Прикладами їх є лід, твердий оксид карбону(ІV) (“сухий лід”), тверді галогеноводні, тверді прості речовини, утворені одно – (благородні гази), двох – (F2, Сl2, Вr2, l2, Н2, О2, N2), трьох – (О3), чотирьох – (Р4), восьми – (S8) атомними молекулами. Більшість кристалічних органічних сполук мають молекулярну решітку.
Додаток 5.
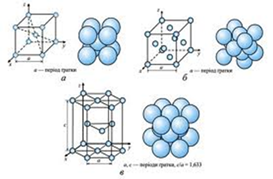
У твердому стані метали утворюють металічні кристалічні решітки. Електрони електростатично притягуються катіонами, що забезпечує стабільність решітки. Метали є речовинами немолекулярної будови. Оскільки атоми елементів-металів здатні віддавати електрони з зовнішнього енергетичного рівня, то у вузлах кристалічної ґратки металів містяться позитивні йони і деяка частина нейтральних атомів. Між ними хаотично пересуваються відносно вільні електрони, які стають спільними для всієї кристалічної ґратки. Таку кристалічну ґратку називають металічною.
Усуспільнені (делокалізовані) електрони, вільно пересуваючись, компенсують сили електростатичного відштовхування між позитивно зарядженими йонами і, таким чином, забезпечують хімічний зв’язок в кристалі металу. Зв’язок, який здійснюють відносно вільні електрони між катіонами металів кристалічної ґратки називають металічним.
Металічний зв’язок міцніший за ковалентний. Він обумовлює схожі фізичні властивості металів. Однак різні метали все-таки відрізняються за деякими властивостями, наприклад, за температурою плавлення, густиною тощо. Ці властивості багато в чому залежать від інших параметрів кристалічних структур.
Металічні кристалічні ґратки бувають різних видів. Вони різняться просторовою структурою і компактністю упаковки частинок, що впливає на фізичні властивості металів.


про публікацію авторської розробки
Додати розробку