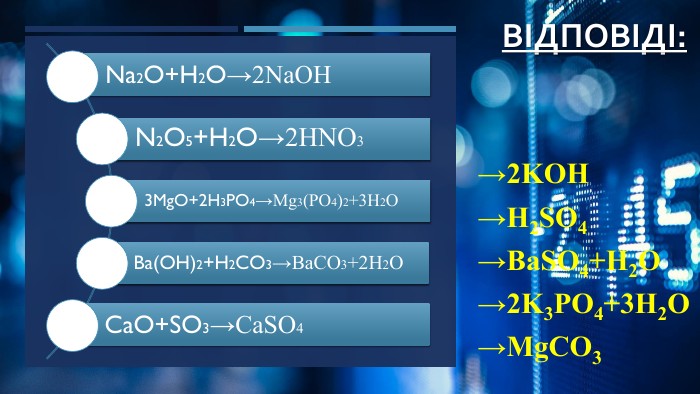
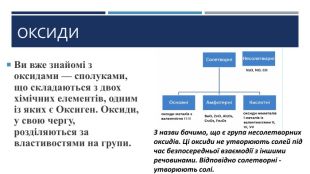
Хімічні властивості амфотерних оксидів
Про матеріал
поглибити знання про основні класи неорганічних речовин; розібрати поняття амфотерності; вивчити властивості амфотерних речовин на прикладі амфотерних оксидів; навчитися складати відповідні рівняння реакцій.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку