Урок "Хімічний зв'язок"










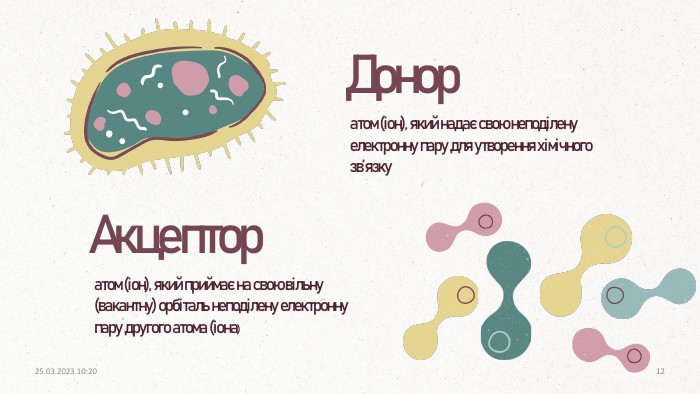
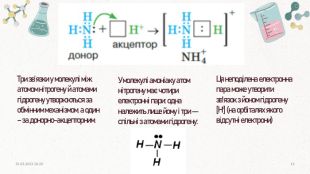
![Три зв’язки у молекулі між атомом нітрогену й атомами гідрогену утворюються за обмінним механізмом, а один – за донорно-акцепторним. Ця неподілена електронна пара може утворити зв'язок з йоном гідрогену [H+] (на орбіталях якого відсутні електрони)У молекулі амоніаку атом нітрогену має чотири електронні пари: одна належить лише йому і три — спільні з атомами гідрогену:20.03.2023 14:1013 Три зв’язки у молекулі між атомом нітрогену й атомами гідрогену утворюються за обмінним механізмом, а один – за донорно-акцепторним. Ця неподілена електронна пара може утворити зв'язок з йоном гідрогену [H+] (на орбіталях якого відсутні електрони)У молекулі амоніаку атом нітрогену має чотири електронні пари: одна належить лише йому і три — спільні з атомами гідрогену:20.03.2023 14:1013](/uploads/files/4447794/343621/396020_images/13.jpg)


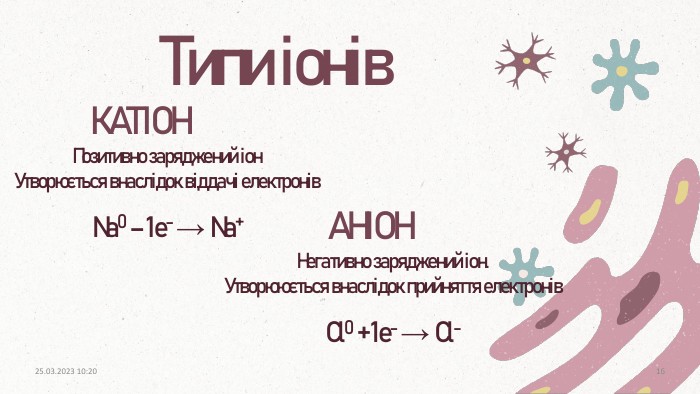
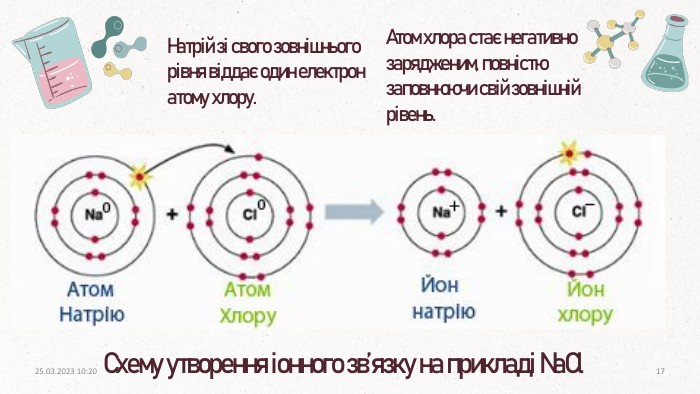







ПОВТОРЕННЯЩо таке електронегативність? Як називається позитивно заряджений іон?Як називається негативно заряджений іон? Як змінюється електронегативність у: групах, періодах?Здатність атомів елемента в хімічних сполуках відтягувати до себе електрони, що беруть участь в утворенні хімічних зв’язків. Аніон. Катіонзверху вниз зменшуєтьсязліва направо збільшуєтьсязверху вниз посилюютьсязліва направо посилюються. Як змінюються неметалічні властивості у періодах?Як змінюються металічні властивості у групах?20.03.2023 14:103
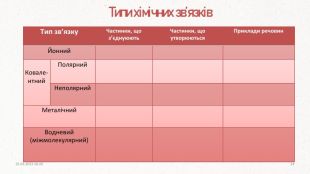
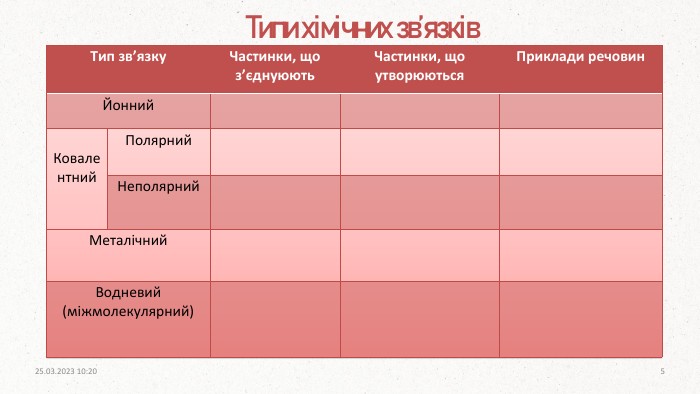
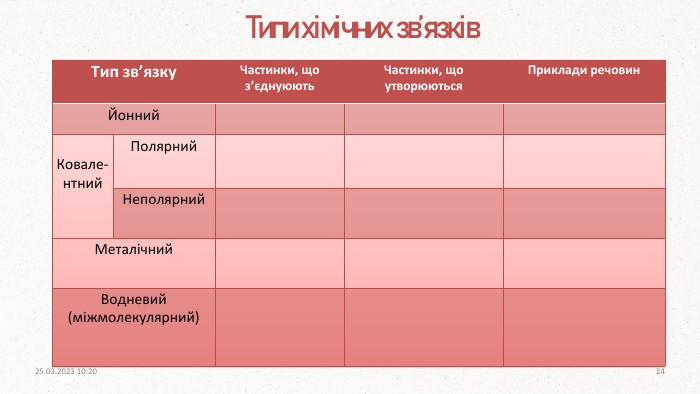
ПОВТОРЕННЯ Ковалентний полярний зв’язок виникає між. Ковалентний неполярний зв’язок виникає міжІонний зв’язок виникає внаслідок взаємодіїМеталічний зв’язок утворюють атоми. З якими сполуками найчастіше гідроген утворює водневий зв’язок? атомами з близькою електронегативністюпротилежно заряджених іоніводнаковими атомамиметалівфлуор, оксиген, нітроген20.03.2023 14:104
Під час взаємодії атомів з незавершеними зовнішніми електронними шарами перебудовуються їх електронні оболонки: неспарені електрони різних атомів утворюють електронні пари, які є спільними для двох чи більшої кількості атомів, або зміщуються до одного атома. 0102 Молекула може утворитися тільки тоді, коли при взаємодії атомів їхня загальна енергія зменшується. Інакше кажучи, утворення хімічного зв'язку завжди супроводжується виділенням енергії, яку називають енергією хімічного зв'язку. Нестійкість атомів з незавершеним зовнішнім рівнем і прагнення до його заповнення. Прагнення до мінімуму енергії20.03.2023 14:107
Ковалентний. НеполярнийІз схеми видно, що утворення хімічного зв’язку можливе тоді, коли спаровуються два електрони з антипаралельними спінами. Якщо спіни електронів в обох атомах мають однаковий напрямок, електрони відштовхуються, і молекула з них утворитися не може. При утворенні хімічного зв’язку в ролі валентних електронів виступають неспарені електрони в незбуджених або збуджених атомах.20.03.2023 14:109
- передбачає усуспільнення неспарених електронів двох атомів. Обмінний механізм- Чи можливий такий механізм для ковалентного полярного типу?Як ви гадаєте в ряду сполук: HI, HBr, HCl, HF полярність молекул зростає, чи ні? Якщо так, спробуйте пояснити чому саме?Полярність молекул зростає, бо зростає різниця електронегативностей атома галогену та гідрогену.20.03.2023 14:1010
Три зв’язки у молекулі між атомом нітрогену й атомами гідрогену утворюються за обмінним механізмом, а один – за донорно-акцепторним. Ця неподілена електронна пара може утворити зв'язок з йоном гідрогену [H+] (на орбіталях якого відсутні електрони)У молекулі амоніаку атом нітрогену має чотири електронні пари: одна належить лише йому і три — спільні з атомами гідрогену:20.03.2023 14:1013
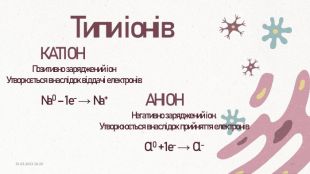
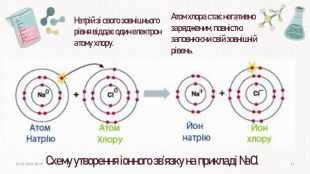
При умові, що різниця електронегативностей пари атомів, що утворюють зв’язок, буде більше, або дорівнювати (≥) 1.7, за Полінгом, між ними утвориться іонний зв’язок. Окремі йонні молекули можуть існувати лише за дуже високої температури (у газоподібному стані). За звичайних умов такі сполуки – тверді кристалічні речовини. Зазвичай такий тип зв’язку утворюється між металічним та неметалічним елементом. Як відомо, катіони і аніони беруть участь у цьому зв’язку, і тим сильніше вони притягуються один до одного, чим більший заряд кожної частинки і чим менша відстань між ними.20.03.2023 14:1015
Атоми металів відносно легко віддають валентні електрони, внаслідок чого утворюються позитивно заряджені йони. Між упорядковано розташованими йонами металічного елемента і відносно вільними валентними електронами виникає електростатичний зв’язок, який і називають металічним. На відміну від йонного та ковалентного хімічних зв’язків, металічний зв’язок не характерний для окремих частинок, а є властивістю їхніх агрегатів у твердому і рідкому стані.20.03.2023 14:1019
Низка сполук з полярним ковалентним зв’язком, які містять гідроген і елемент з високою електронегативністю (найчастіше оксиген, флуор, нітроген), утворюють так званий водневий зв’язок. Це різновид невалентного міжмолекулярного зв’язку, який виникає між атомами гідрогену однієї молекули (диполя) з поляризованим атомом (що має велику електронегативність: F, N, O) другої молекули внаслідок набуття ними протилежних часткових електричних зарядів. Водневий зв'язок впливає на фізичні властивості речовин – підвищуються температури плавлення й кипіння, зменшується густина. Це пов’язано з тим, що потрібна додаткова енергія для розриву водневого зв’язку. 20.03.2023 14:1021
{9 DCAF9 ED-07 DC-4 A11-8 D7 F-57 B35 C25682 E}КП ( ковалентний полярний)КН (ковалентний неполярний)З наведених сполук вибрати у 2 колонки сполуки з ковалентним полярним(КП) та ковалентним неполярним(КН) зв’язком. Сполуки: HCl, NH3, CCl4, H2, F2, CO, CH4, Br2, H2 S, N2, O2 Вправи. Намалювати за допомогою електронних формул утворення сполук: H2 S O2020120.03.2023 14:1023


про публікацію авторської розробки
Додати розробку