урок: Хімія 10 клас факультатив Обчислення швидкості хімічної реакції
Хімія 10клас факультатив
Урок №25. Дата:22.03.2013
Тема уроку: Обчислення швидкості хімічної реакції
Мета уроку: Навчити учнів розв'язувати задачі на обчислення швидкості хімічної реакції . Розвивати вміння учнів розв’язувати задачі на логічне мислення. Сформувати зв'язок хімії з іншими науками.
Тип уроку: комбінований
Структура уроку:
І Організаційний етап. 1хв.
ІІ Перевірка домашнього завдання 2хв.
ІІІ Вивчення нового матеріалу 15хв.
ІV Узагальнення знань 20хв.
V Підсумок уроку 2хв.
VІ Домашнє завдання 5хв.
Хід уроку:
І Організаційний етап.
ІІ Перевірка домашнього завдання
Перевіряється письмове виконання домашнього завдання
ІІІ Вивчення нового матеріалу
Вам вже відомо із курсу фізики, що, швидкість – це величина, яка чисельно дорівнює шляху, який проходить тіло за одиницю часу.
Ви вже вивчаєте хімію з 7 класу. А чи зустрічалися ви із поняттям швидкості в хімії?
Отже, швидкість хімічних реакцій, пов’язана із зміною кількості речовини реагенту чи продукту реакції в одиниці об’єму. Величина що показує вміст кількості речовини в одиниці об’єму називається концентрацією.
![]() ,
,
де c – концентрація , ν – кількість речовини [моль], V – об’єм [л].
Отже, швидкість реакції це зміна концентрації одного з реагентів чи одного з продуктів реакції за одиницю часу при незмінному об’ємі системи.
 ,
,
де v – швидкість хімічної реакції , c1 та c2 – початкова та кінцева концентрація (відповідно) , t1 та t2 – початковий та кінцевий час (відповідно) [с], ![]() – зміна концентрації ,
– зміна концентрації , ![]() – проміжок часу [с].
– проміжок часу [с].
Вивченням швидкості хімічних реакції займається спеціальний розділ хімії – хімічна кінетика. Серед учених, що зробили вагомий внесок у її розвиток, багато імен, зокрема: Якоб Вант-Гофф (перший лауреат нобелівської премії з хімії (1901 р), якої удостоєний був за ряд відкриттів, одне з яких правило, що носить його ім’я), Сванте Арреніус (лауреат нобелівської премії за відкриття в області розчинів, відкрив залежність миттєвої швидкості реакції від температури), а також Петер Вааге, М. М. Семенов та інші. Швидкість хімічної реакції залежить від багатьох факторів.
Розглянемо схему.
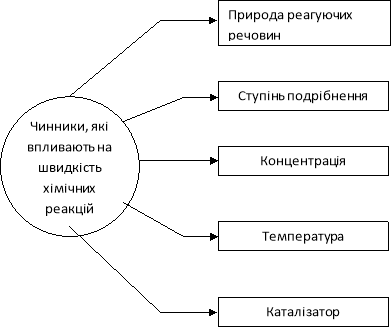
Правило Вант-Гоффа:
Із збільшенням температури на кожні 10 ˚C швидкість реакції збільшується в середньому у 2–4 рази.
 ,
,
У 1867 р. норвезькі дослідники Гульдберг та Вааге сформулювали закон діючих мас. Який виражає зв’язок між швидкістю реакції та концентраціями речовин.
Швидкість гомогенної реакції пропорційна добутку концентрацій реагуючих речовин.
Для реакції виду aA(г) + bB(г) → cC(г) + dD(г) кінетичне рівняння матиме вигляд:
 ,
,
де k – константа швидкості реакції, c(A) та c(B) – концентрації речовин А та В відповідно , a та b – коефіцієнти із рівняння реакції.
ІV Узагальнення знань
Розв’язати задачі № 12, 13, 14 із збірника задачі на сторінці 18
V Підсумок уроку
VІ Домашнє завдання
Задачі №15, 16 на сторінці 18


про публікацію авторської розробки
Додати розробку
