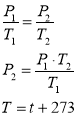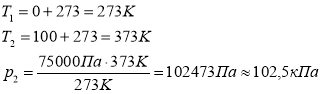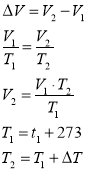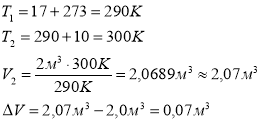Урок "Ізопроцеси. Газові закони"
Тема уроку: Ізопроцеси. Газові закони.
Мета уроку:
навчальна: вивчити поняття ізопроцесів і газові закони та перевірити на досліді їх справедливість. Навчити учнів будувати графіки і розв’язувати задачі з їх використанням;
розвиваюча: розвивати спостережливість, логічне та творче мислення, інтерес до фізичної науки; сприяти розвитку пізнавальних здібностей учнів;
виховна: розширювати світогляд учнів, виховувати вміння формулювати і відстоювати свою думку, впевненість у власних здібностях і знаннях.
Тип уроку: Урок засвоєння нових знань.
Обладнання: Гофрований циліндр, манометр, з’єднувальні трубки, посудина з теплою водою, термометр, портрети вчених, таблиці, написи і графіки на дошці, карточки тестів для контролю знань.
ХІД УРОКУ.
I. Актуалізація опорних знань.
1. Завдання на карточках тестового контролю (для 4 учнів).
2. Дати відповіді на запитання:
а) Назвіть основні положення молекулярно - кінетичної теорії.
б) Назвіть основні властивості газів і як вони залежать від молекулярної будови.
в) Який газ називають ідеальним?
г) Якими основними параметрами характеризують газ (термодинамічну систему - p, V, T)?
д) Що називають рівнянням стану ідеального газу?
е) Сформулюйте і напишіть рівняння Менделєєва-Клапейрона?
![]()
R – універсальна газова стала; R=8.31 Дж/моль∙К
є) Сформулюйте і напишіть рівняння Клапейрона?
Для даної маси газу m=const; M=const; R=const;
![]()
![]()
II. Мотивація навчальної діяльності учнів.
Рівняння стану ідеального газу дозволяє описати , що відбувається з газом за будь-яких змін всіх його параметрів. Однак багато процесів у газах, що відбуваються у природі, або здійснюються за участю техніки, набувають зміни тільки двох параметрів при сталій масі газу.
Розглянемо газові процеси, у яких один із трьох параметрів - тиск р, об’єм V чи температура T залишаються постійними, а два інших змінюються.
Такі процеси називають ізопроцесами.
III. Повідомлення теми і мети уроку.
IV. Сприйняття та первинне усвідомлення матеріалу.
- Поняття ізопроцесів і газових законів.
Ізопроцеси –це процеси, які відбуваються при незмінному значені одного з макроскопічних параметрів( p, V або T).
Скільки ізопроцесів ми будемо досліджувати?
Газові закони – це закони, які встановлюють кількісну залежність між двома параметрами стану ідеального газу для ізопроцесів.
2. Ізотермічний процес.
Процес, що відбувається з даною масою газу при сталій температурі, називають ізотермічним (m=const, T=const).
Якщо маса газу не змінюється, то для цього процесу можна записати:
![]()
У даному процесі температура не змінюється, тобто Т1 = Т2. Тому.
![]()
Одержана формула виражає закон, встановлений дослідним шляхом в другій половині 17 століття англійським ученим Робертом Бойлем і французьким ученим Едмом Маріоттом, тому цей закон має назву закону Бойля-Маріотта.
Його можна сформулювати так: для даної маси газу при сталій температурі добуток тиску на його об’єм є величина стала.
![]() Отже залежність між тиском і об’ємом обернено пропорційна, а графік цієї залежності – гіпербола.
Отже залежність між тиском і об’ємом обернено пропорційна, а графік цієї залежності – гіпербола.
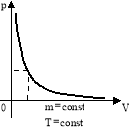
Цю криву називають ізотермою.
Експериментально перевіряємо закон Бойля-Маріотта з допомогою гофрованого циліндра приєднаного до манометра.
Робимо висновок про те що закон Бойля-Маріотта справджується.
3. Ізобарний процес.
Процес, що відбувається з даною масою газу при сталому тиску, називають ізобарним (m=const, p=const)..
– Який зв’язок між об’ємом і температурою в ізобарному процесі?
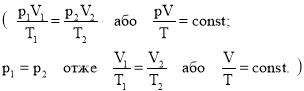
Цей закон встановлений експериментально французьким фізиком Ж. Гей-Люссаком у 1802 р. і названий на честь вченого законом Гей-Люссака.
Він формулюється так: для даної маси газу при сталому тиску відношення об’єму до температури є величина стала.
Графіком залежності об’єму від температури є пряма лінія яку
називають ізобарою.
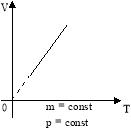 Зверніть увагу на те, як зображена ізобара біля абсолютного нуля.
Зверніть увагу на те, як зображена ізобара біля абсолютного нуля.
Експериментально перевіряємо закон Гей-Люссака.
Робимо висновок про те що закон справджується.
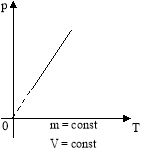
4. Ізохорний процес.
Процес, що відбувається з даною масою газу при сталому обємі, називають ізохорним (m=const, V=const).
– Який зв’язок між тиском і температурою при ізохорному процесі? Чому?
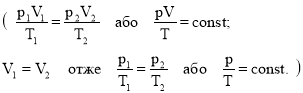
Ця залежність між тиском і температурою була експериментально встановлена у 1787 році французьким ученим Жаком Шарлем і має назву закону Шарля.
Формулюється закон так: для даної маси газу при сталому об’ємі відношення тиску до температури є величина стала.
Графіком залежності тиску від температури є пряма лінія яку
називають ізохорою.
Експериментально перевіряємо закон Шарля з допомогою гофрованого циліндра приєднаного до манометра, помістивши циліндр у теплу воду.
Робимо висновок про те що закон Шарля справджується.
5. Для чого потрібні газові закони?
а). вони дають змогу визначити як буде змінюватися один з параметрів газу, якщо відомо зміну другого (в газових балонах);
б). для дослідження теплових явищ( в двигунах, холодильниках, в теплових насосах);
в). можна передбачити, як будуть відбуватися різні процеси при певних зовнішніх умовах;
V. Узагальнення та систематизація знань.
1. Дати відповіді на запитання:
а) Що називають ізопроцесами?
б) Які ви знаєте ізопроцеси?
в) Якими законами вони описуються?
2. Розв’язати задачу.
При температурі 0 oС тиск у газовому балоні становить 75 кПа. Яким буде тиск газу у балоні при температурі 100 oС?
|
Дано: V = const t1 = 0 oC p1 = 75 кПа=75000 Па t2 = 100 oC |
|
|
|
p2 – ? |
- Розв’язати задачу.
Повітряна куля при 17 oС має обєм 2 м2. На скільки зміниться об’єм кулі, якщо температура зросте на 10 oС?
|
Дано: P = const t1 = 17 oC V1 = 2 м3 ∆t = 10 оС
|
|
|
|
ΔV - ? |
- Реферат учня про вклад українських вчених у розвиток молекулярної фізики.
-
Підведення підсумків уроку.
Підсумовуємо вивчене на уроці. Виставляємо і мотивуємо оцінки активним учням. - Домашнє завдання: §21, задача 1(ст. 196), Л.Е.Генденштейн, І.Ю.Ненашев "Фізика 10 кл.", 2010 р.
Використана література:
- М.В. Головко "Фізика 10 кл.", Київ, 2018 р.
- Л.Е. Генденштейн, І.Ю.Ненашев "Фізика 10 кл.", Харків, 2010 р.
- А.П. Римкевич "Збірник задач з фізики", Харків, 2005 р.
- Г.Г. Кордун "Учням про видатних фізиків", Київ, 1989 р.
- Г.Г. Кордун "Історія фізики", Київ, 1984 р.


про публікацію авторської розробки
Додати розробку