Урок КИСЛОТИ.CКЛАД.КЛАСИФІКАЦІЯ.ВЛАСТИВОСТІ. 8 клас
УРОК
Тема: Кислоти.
Клас: 8
Підручник Г.A. Лащевська ХІМІЯ -8 клас.
Мета:
Формувати:
Знання:
-Поняття про кислоти, їх склад, назви, класифікацію.
-Фізичні властивості кислот.
-Хімічні властивості кислот.
-Роль кислот у природі та житті людини.
Уміння:
-Виконувати хімічні досліди з кислотами.
-Складати рівняння хімічних реакцій з участю кислот.
Навички:
-Використовувати хімічну мову для чіткого та зрозумілого викладу знань про кислоти.
-Застосовувати знання про кислоти в повсякденному житті.
-Розвивати вміння працювати з підручником, таблицями, формулами, виконувати лабораторні роботи
Формувати такі компетенції:
- предметну -засвоєння знань про кислоти, їхні властивості, застосування, а також уміння застосовувати ці знання для розв'язання задач;
- математичну -як уміння застосовувати математичні знання для розв'язання хімічних задач;
- комунікативну- яка передбачає уміння висловлювати свої думки й обмінюватися інформацією з однолітками та дорослими;
- інформаційно-цифрову -яка передбачає уміння використовувати цифрові технології для пошуку та обробки інформації;
- екологічну -яка передбачає розуміння впливу кислот на навколишнє середовище та здоров'я людини;
- соціальну та громадянську -яка передбачає здатність брати участь у суспільному житті та розуміти цінності демократичного суспільства.
Р.S.Якщо хтось вважає,що мета велика, то повірте з власного досвіду, продумана мета –половина успіху.
Тип уроку: Засвоєння нових знань.
I. Організаційний момент
II. Мотивація. Яке значення має технологія “Кріспер” для хімії і до нашого уроку? [ якщо учні не знають відповіді , запитання залишається відкритим на домашнє завдання] .
ІIІ. Актуалізація опорних знань
Повідомляю тему, завдання:
Самостійна робота
-Читають епіграф і завдання після епіграфа параграф 27 п ояснюють, формулюють мету і завдання уроку.{Я доповнюю}
-Розглядають рис 27.1 і 27 .3 підручнику і пояснюють


IV. Вивчення нового матеріалу:
Самостійна робота з підручником
Сьогодні максимальну увагу приділяю роботі з підручником{таблиці,схеми} результат у рази кращий як перегляд презентацій.
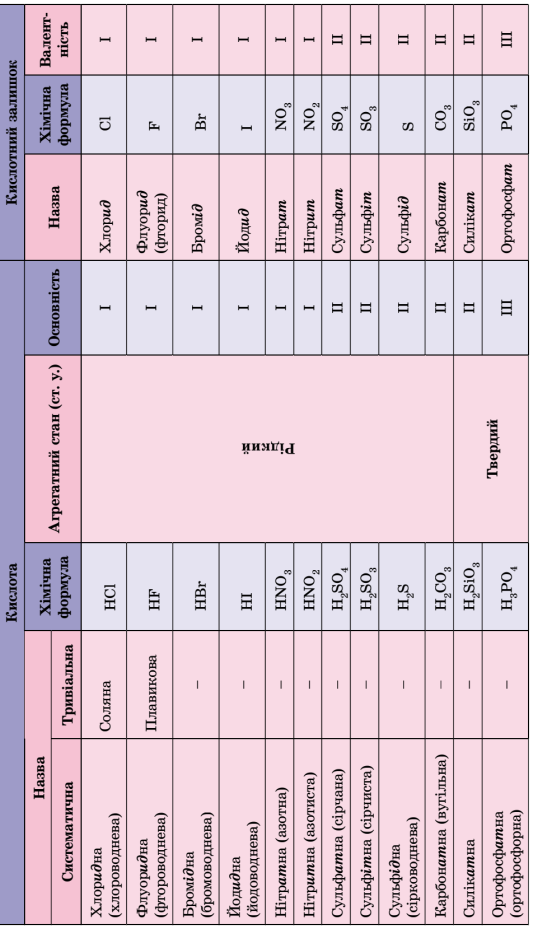
Учні в парі розглядають таблицю з кислотами і обговорюють : назви, самостійно дають визначення і формули записують у зошит.
Робота за методикою “ПЕРЕВЕРНУТИЙ КЛАС”
_фізичні властивості кислот.
-знайомство з термінами "сильні" та "слабкі" кислоти
-класифікація кислот
-поділ за походженням (органічні та неорганічні).
Учні пояснюють з використанням своїх презентацій .
Робота з таблицями
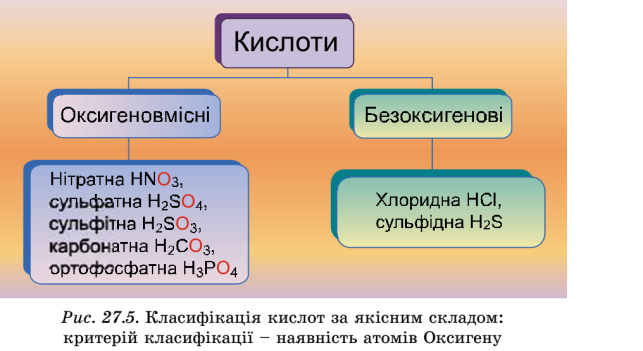
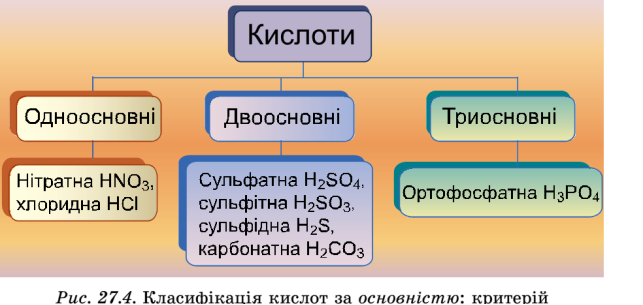
Кількість атомів Гідрогену здатних заміститись на атоми металу.
Переходимо до вивчення :
ХІМІЧНИХ ВЛАСТИВОСТЕЙ {Демонстрації з записом хімічних рівнянь}
Особливу увагу приділяю формуванню умінь та навичок учнів працювати з хімічними реактивами та обладнанням. Для цього проводжу лабораторні і демонстраційні досліди, а на наступному уроці – практикум, під час яких учні вчаться:
-Правильно використовувати хімічні реактиви та обладнання.
НАГОЛОШУЮ –КИСЛОТУ ВЛИВАЄМО В ВОДУ.
-Дотримуватися правил техніки безпеки при роботі з кислотами.
-Виконувати хімічні досліди відповідно до інструкції.
Формування інтересу учнів до вивчення цієї теми забезпечую демонстраціями, а на наступному уроці – практикум.
-Змінюють забарвлення індикаторів. Водні розчини кислот змінюють забарвлення індикаторів. Фіолетовий лакмус, метилоранж і універсальний індикатор стають червоними в кислому середовищі.{Учні складають табличку}
-Реагують з металами. Кислоти реагують з металами, які стоять у ряду активності до водню, з утворенням солі та водню. Наприклад, якщо до розчину хлоридної кислоти додати залізний цвях, то відбудеться реакція:
Fе+ 2HCl → FеCl2 + H2
-Реагують з основними і амфотерними оксидами. Кислоти реагують з основними і амфотерними оксидами з утворенням солі та води.
До розчину хлоридної кислоти додаємо оксид магнію, то відбудеться реакція:
MgO + 2HCl → MgCl2 + H2O
-Реагують з основами і амфотерними гідроксидами. Кислоти реагують з основами і амфотерними гідроксидами з утворенням солі та води.
До розчину хлоридної кислоти додатємо натрій гідроксид, то відбувається реакція:
HCl + NaOH → NaCl + H2O
-Реагують з солями. Кислоти можуть реагувати з солями, утворюючи нову кислоту і нову сіль.
До розчину хлоридної кислоти додати натрій карбонат, то відбудеться реакція:
2HCl + Na2CO3 → 2NaCl + H2O + CO2
Всі реакції учні записують у зошиті і пояснюють все,що спостерігають.
{Я включаюсь коли виникає проблемне питання і учні самостійно не можуть вирішити}
Деякі кислоти, такі як хлоридна кислота, сірчана кислота, азотна кислота, легко розкладаються при нагріванні. Наприклад, при нагріванні хлоридної кислоти відбувається реакція:
2HCl → H2 + Cl2 {Цей дослід не проводжу}
V. Рефлексія
Обговорення в парах:Розумію, Не розумію
-Використання проблемних питань. -ЩО КРАЩЕ ДО БОРЩУ ОЦТОВА КИСЛОТА ЧИ ЛИМОННА?
-ЯКУ КИСЛОТУ ДОДАЄМО ДО БОРЩУ ЗІ ЩАВЛЮ?
Залучення учнів до самостійної роботи. Малюють сонечко, на кожному промені,що вз'яв з уроку.
VI. Підсумок уроку
1. Що нового ви дізналися на уроці?
2. Що було найцікавішим?
VII. Домашнє завдання: Підготувати короткий огляд властивостей та застосувань однієї конкретної кислоти. [хлоридної, сульфатної, карбонатної і ін.]
-Учні можуть використовувати пластилін щоб створити модель атома кислоти. - повідомлення Кислоти – користь чи шкода. [за бажанням]
Опрацювати § 28 підручника.
Задача для бажаючих
-Розв'язування задачі на застосування кислот у повсякденному житті.
Маса розчину оцтової кислоти3кг, масова частка кислоти 6%Знайти масу чистої кислоти в розчині?
Для чого молюскам кислота?



про публікацію авторської розробки
Додати розробку
