Урок "Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції: сполучення, розкладу, заміщення, обміну "
Тема: Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції: сполучення, розкладу, заміщення, обміну.
Мета: узагальнити й систематизувати знання учнів про хімічні реакції;
- розвивати вміння й навички визначення типів хімічних реакцій за схемами рівнянь;
- продовжити формування вмінь складати рівняння хімічних реакцій, розміщу-вати коефіцієнти на основі закону збереження мас;
- розвивати спостережливість, логічне мислення, вміння порівнювати, аналізу-вати, встановлювати причинно - наслідкові зв’язки;
- створити умови для вільного висловлювання та аналітичної роботи;
- встановити взаємозалежність між навчальними дисциплінами, розкриваючи міжпредметні зв’язки;
- виховувати організованість, відповідальність.
Завдання:
- узагальнити й систематизувати знання про хімічні реакції;
- розвивати вміння й навички визначення типів хімічних реакцій за рівняннями;
- продовжити формування вміння складати рівняння хімічних реакцій, розміщення коефіцієнтів на основі закону збереження мас.
Тип уроку: комбінований урок засвоєння нових знань, узагальнення вмінь і навичок та застосування їх на практиці.
Форми роботи: розповідь учителя, фронтальна робота, індивідуальна.
Метод проведення: інтерактивний
Обладнання: ноутбук, мультимедійний проектор, лабораторне приладдя, реактиви.
Засоби навчання: підручник, роздатковий матеріал, таблиці, карти, схема.
Структура уроку :
І. Організаційний етап. (2хв)
ІІ. Актуалізація опорних знань. (10хв)
ІІІ. Основна частина уроку. (20хв)
ІV. Заключна частина.(5хв)
V. Домашнє завдання. (3хв)
ХІД УРОКУ
І. Організаційний етап
Формула успішного урок

Саме ці якості потрібні нам для успішної співпраці.
ІІ. Актуалізація опорних знань. Мотивація навчальної діяльності
2.1. Актуалізація та коригування опорних знань учнів
«Все тече, все змінюється », - стверджували давні філософи і повторюємо ми з вами в різних ситуаціях. І дійсно, все навколо нас і ми самі весь час змінюємося. Які ж зміни, що відбуваються, мають відношення до хімії?
1. Я пропоную вам зіграти в гру «Вірю – не вірю»
Я буду називати вам різні явища, які відбуваються навколо нас, а ви визначте: відносяться вони до хімічних чи ні?
1. Дощ на вулиці …………( ні )
2. Жовтіння листя …….( так)
3. Утворення іржі на поверхні цвяха ..( так)
4. Туман на дорозі …..( ні )
5. Скисання молока ….( так ) карточка
- Давайте проаналізуємо, що об’єднує явища, які ми визначили як хімічні. І чи буде правильне твердження : «хімічне явище – це є хімічна реакція»?
1.2 Фейсбук- сторінка
Сьогодні ми з вами не уявляємо своє без соціальних мереж. І зараз я пропоную вам урізноманітнити наш урок і скористатися фейсбук- сторінкою «Хімічні реакції» і виконати завдання на повторення (Зверніть увагу на екран).
2.1. Мотивація пізнавальної діяльності учнів
Проблемне питання «Коктейль Клеопати»
В історичних довідках згадують парі єгипетської цариці Клеопатри та Марка Антонія. В тодішні часи розваг було не так багато, тож і вигадували всілякі несусвітні речі. Якось від нічого робити, цариця запропонувала Марку Антонію закластися, що вона вип’є на вечерю вино вартістю в 10 мільйонів сестерцій. На ті часи, цілий статок, а винні колекції тоді ще не набули поширення. Що стояло на кону між коханцями, наразі ніхто не знає. Але зваживши всі «за» і «проти», особливо пропозиції тодішнього ринку вин, римський консул згодився. Він явно розраховував виграти і навряд чи мова йшла про якісь грошову ставку. Швидше за все, на кону стояло якесь незвичне прохання.
Але Клеопатра, яка ввійшла в історію як дуже мудра і хитра жінка, і тут обдурила наївного Антонія. Тільки-но почався їхній бенкет, цариці піднесли кубок з винним оцтом. Вельможна єгиптянка демонстративно вийняла з вуха сережку з великою чорною перлиною, яка, власне, і коштувала 10 мільйонів сестерцій, і вкинула в бокал. Наприкінці вечері вона випила його одним залпом і Марк Антоній мусив визнати свій програш.
А яка це хімічна реакція була основою такого ризикованого, на перший погляд, учинку цариці, ви дізнаєтесь наприкінці нашого уроку.
Відкрийте, будь ласка, зошити, запишіть число та тему над якою будемо працювати «Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції. Реакції сполучення, розкладу, заміщення, обміну»
Мета нашого уроку:
- Ознайомитись з ознаками класифікації хімічних реакцій:
- Навчитись розрізняти реакції сполучення, розкладу, заміщення, обміну;
- Вміти наводити приклади вивчених типів хімічних реакцій.
ІІІ. Основна частина уроку
3.1. Вивчення нового матеріалу
Кожна хімічна реакція індивідуальна, оскільки в неї беруть участь конкретні хімічні речовини з притаманними їм властивостями . Разом з тим, різні хімічні реакції мають багато спільних ознак, що дає змогу класифікувати їх на підставі тієї чи іншої ознаки.
Розглянемо перший тип: ТБ картки
Учитель. А зараз вашій увазі я пропоную переглянути демонстрацію досліду.
Розкладання дихромата амонію ( «вулкан»). (Але перед цим давайте згадаємо правила ТБ)
Перед нами - помаранчеві кристали дихромата амонію. Палаюча лучинка викликає бурхливу реакцію. Дихромат амонію - особлива сіль, в її складі - окисник і відновник. Тому «всередині» цієї солі може пройти окислювально-відновна реакція.
(NH4)2Cr2O7 = Cr2 3 + N2 + 4H2O
Окисник - хром (VI) перетворюється в хром (III), утворюється зелений оксид хрому. Відновник - азот, що входить до складу іона амонію, перетворюється в газоподібний азот. Отже, Дихромат амонію перетворюється в зелений оксид хрому, газоподібний азот і воду: ми спостерігаємо реакцію розкладання солі. Реакція почалася від палаючої скіпки, але не припинилася, коли лучинку прибрали, а стала ще інтенсивніше. Справа в тому, що в процесі реакції виділяється теплота, і розпочавшись від лучінкі, процес лавиноподібно розвивається до тих пір, поки вся маса дихромата чи не перетвориться в оксид хрому (III), азот і воду. Оксид хрому - дуже тверде, тугоплавка речовина зеленого кольору, його використовують як абразив. Температура плавлення - майже 2300 градусів. Оксид хрому - дуже стійке речовина, що не розчиняється навіть в кислотах. Завдяки стійкості та інтенсивної забарвленням окис хрому використовується при виготовленні масляних фарб.
- Реакції розкладу - хімічні реакції, в результаті яких із однієї складної речовини утворюється дві чи більше нових речовин.
АВ → А +В
Перед тим як розглянути другий тип реакцій пропоную об’єднатися в дві групи ( І група О, ІІ група Н)
Другий тип :
Учитель. А зараз ми проведемо лабораторний експеримент: Сполучення Якщо до негашеного вапна (СаО) добавити воду, утворюється гашене вапно Са(ОН)2. Реакцію можна виразити таким рівнянням реакції:
- СаО + Н2О = Са(ОН)2. + Q. Реакція супроводжується виділенням тепла.
- Реакції сполучення - хімічні реакції, в результаті яких із двох або кількох речовин утворюється одна нова складна речовина.
А +В = АВ
Учитель Пропоную виконати завдання № 1.
В кожного з вас на парті лежать формули реагентів хімічного рівняння вам потрібно знайти в класі продукт хімічного рівняння і тип до якого відноситься дане рівняння.
2KCIO3 = 2KCI + O2 Розкладу
С+О2 = СО2 Сполучення
СаО + Н2О = Са(ОН)2 Сполучення
(NH4)2Cr2O7 = 2NH3 + 2 СrO3 + H2O Розкладу
СО2 + Н2О = Н2СО3 Сполучення
2КМnО4 = К2МnО4 + МnО2 + О2 Розкладу
2Н2О = 2Н2 + О2 Розкладу
N2 + 3H2 = 2NH3 Сполучення
2Mg + О2 = 2MgO Сполучення
SO2 + Н2О = H2SО3 Сполучення
Сu(ОН)2 = СuО + Н2О Розкладу
СаСО3 = СаО + СО2 Розкладу
2КNО3 = 2КNО2 + О2 Розкладу
Третій тип:
Учитель. Давайте звернемося до «Віртуальної хімічної лабораторії» Переглянемо демонстрацію
- 2Zn + O2 = 2ZnO
- Реакції заміщення – хімічні реакції між простою і складною речовинами, під час яких атоми простої речовини заміщують атоми одного з елементів у складній речовині, утворюючи нову просту і нову складну речовини.
А +ВС = АС + В
Четвертий тип:
![]() Учитель. Лабораторний експеремент: 5мл H2O2 +2г марганець IV оксид МnO2 +H2O2= H2Mn+2O2
Учитель. Лабораторний експеремент: 5мл H2O2 +2г марганець IV оксид МnO2 +H2O2= H2Mn+2O2
До якого типу відноситься дана реакція?
- Реакції обміну - хімічні реакції, під час яких дві речовини обмінюються своїми складовими частинками, утворюючи дві нові речовини.
АВ +СD = АD + CВ
Учитель Пропоную виконати завдання № Хмаринка
На фейсбук-сторінці в колбі розмішені формули випишіть схеми хімічних реакцій і визначте тип даної формули.
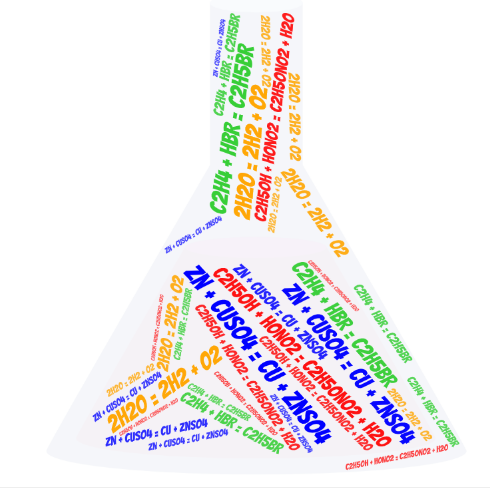
Тож давайте повернемося до стародавнього Єгипту на бенкет до Клеопатри.
Цей історичний факт свідчить про те, що Клеопатра була мудрою не лише життєвим досвідом, а й дещо знала про властивості перлів. Хімічно ці дорогоцінні скарби моря є не чим іншим, як карбонатом кальцію. Він взаємодіє з оцтовою кислотою і утворює нейтральний розчин, який цілком безпечно можна вживати.
ІІІ. Заключна частина уроку
Художнику доручили ілюструвати підручник хімії для дев'ятикласників. Хімічні реакції розкладу, сполучення, заміщення, обміну він зобразив у такий спосіб (мал. 13.6). Оцініть, чи правильно художник змоделював хімічні реакції різних типів. Обґрунтуйте свій експертний висновок.

Підбиття підсумків роботи на уроці. Рефлексія
«Смайл»
А тепер мені хотілося б отримати від вас зворотній зв'язок. Виразіть будь ласка свої враження від уроку в звичний для нас спосіб за допомогою фейсбук смайлів.
ІV. Домашнє завдання.
Параграф 13 с.77 №98
Додаткове завдання. 



про публікацію авторської розробки
Додати розробку
