Урок "Корозія металів.Види корозії".
Хімія
Урок на тему: «Корозія металів. Види корозії: хімічна та електрохімічна. Захист від корозії»
Дмитрик О.Б.,
викладач хімії та біології
Дрогобицького професійного
політехнічного ліцею
Тема уроку: Корозія металів. Види корозії: хімічна та електрохімічна. Захист від корозії
Мета уроку:
- освітня: ознайомити з корозією металів як окисно-відновним процесом; з’ясувати суть хімічної та електрохімічної корозії металів; розглянути способи захисту металів від корозії
- виховна: формувати активну життєву позицію, вміти застосовувати одержані знання на практиці з метою захисту металів від корозії, бережливого ставлення до навколишнього середовища
- розвивальна: розвивати уміння аналізувати, порівнювати, узагальнювати, робити самостійні висновки; розвивати пізнавальний інтерес до предмету, використовуючи комп’ютерні технології
Тип уроку: урок вивчення нового матеріалу та первинного закріплення знань
Базові поняття: корозія, хімічна корозія, електрохімічна корозія, інгібітори,
протектори
Обладнання і реактиви: шість пробірок, шість залізних цвяхів, розчин натрій хлориду, вода, розчин натрій гідроксиду, лак, мідний дріт, цинкові пластини; комп’ютер, мультимедійний проектор, тестові завдання
Форми роботи: індивідуальна, групова, фронтальна
Очікувані результати – учень засвоїв і вивчив:
- поняття «корозія»
- види корозії
- методи захисту металу від корозії
Епіграф
Знати – значить перемагати
Хід уроку
- Організаційний момент (привітання, з’ясування відсутніх, побажання гарного настрою, позитивного спілкування та активної роботи)
- Актуалізація опорних знань(слайд№1,2)
Фронтальне опитування:
- Назвіть метал, що входить до складу гемоглобіну крові:
а) Mg; б) Al; в) Fe
- Який метал є найтугоплавкішим:
а) Pb; б) W; в) Cr
- Назвіть метал, що здатен намагнічуватися:
а) Ni; б) Cr; в) Mg
- Який метал найлегший:
а) Mg; б) Li; в) Al
- Зв'язок в металах називається:
а) йонний; б) ковалентний; в) металічний
- Назвіть найпоширеніший у природі металічний елемент:
а) Fe; б) Al; в) Mg
- Метал, що має найбільшу густину:
а) Fe; б) Os; в) Pb
- Який метал здатний «бігати» по гладкій поверхні:
а) Na; б) Br; в) Hg
- Назвіть метал, що має бактерицидні властивості:
а) Ag; б) Co; в) Sn
- Сполуки металів з оксигеном:
а) сульфіди; б) оксиди; в) нітриди
- Лідер серед металів по електропровідності:
а) Al; б) Ag; в) Cu
- Найпластичніший метал:
а) Al; б) Au; в) Zn
- Мотивація навчальної діяльності і повідомлення теми уроку(слайд№3)
Ми продовжуємо вивчати тематичний блок «Метали» і сьогодні познайомимося з цікавою властивістю металів, яку можна назвати «хворобою» металів. Я думаю, ви здогадаєтеся про що буде йти мова, вставивши пропущені слова в українські народні приказки:
- Поки залізо в роботі, його _____ не візьме.
- Гризе мов _____ залізо.
- Залізо _____ з’їдає, а заздрий від заздрощів погибає.
- _____ їсть залізо, а горе – серце.
- _____ їсть залізо, а чоловіка - хвороба.
Так, сьогодні ми поговоримо саме про іржу, найбільшого ворога металів.
- Вивчення нового матеріалу
Метали часто змінюють свій початковий вигляд. Залізо ржавіє, мідь, срібло тьмянішають і втрачають характерний блиск. Іржавіння заліза є одним із прикладів корозії металів. Корозію називають «ворогом металів». В жертву корозії приноситься 10% металу, який щорічно виробляє людство. Із латинської мови слово «корозія» - роз’їдати. Із корозією металів ми зустрічаємося щодня. Іржавіє сталь, зеленіє мідь, біліє цинк… Корозію можна також порівняти із хворобою, на яку хворіють метали. А хворобу важливо вчасно діагностувати, лікувати, здійснювати заходи профілактики.
Величезні океанські судна час від часу доводиться ставити в доки на капітальний ремонт і замінювати «з’їдену» морською водою обшивку бортів. Внаслідок корозії виходять з ладу машини, прилади, апарати. Корозія металів призводить до аварій (проривів) каналізаційних і водопровідних труб, газопроводів, що часто згубно впливає на навколишнє середовище. Витрати пов’язані із корозією становлять 7-8 % національного доходу.
Вчитель оголошує тему уроку.
Корозія – явище руйнування металів та їх сплавів під впливом речовин навколишнього середовища.
Корозія металів відбувається в різних середовищах:
- на повітрі (вологому і сухому);
- у воді (у тому числі і в морській);
- у ґрунті;
- у розчинах електролітів, ін.
Швидкість корозії залежить від природи середовища, від температури, кислотності, від природи металу, стану його поверхні, способу його експлуатації тощо.
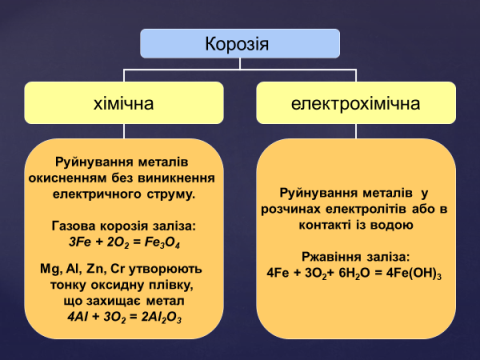
Корозія може бути хімічна те електрохімічна.
Хімічна корозія – це руйнування металу його окисненням без виникнення електричного струму в системі. В природі практично не зустрічається, але спостерігається в апаратах хімічного виробництва. Хімічна корозія полягає у взаємодії металу із сухими газами (O2, Cl2, H2S). Її результат – утворення на поверхні металу шару або плівки оксиду, сульфіду чи інших сполук. Під час хімічної корозії метал безпосередньо взаємодіє з окисником, наприклад: залізо в сухому повітрі за звичайних умов не змінюється, а під час нагрівання взаємодіє з киснем (в кузнях, на прокатних станах: 3Fe + 2O2 = Fe3O4)
Електрохімічна корозія – руйнування металів у середовищі електролітів з утворенням електричного струму в системі (окиснення металу, що знаходиться в контакті з іншим металом або водою).
Причини виникнення корозії металів полягають в хімічній взаємодії їх з речовинами, які знаходяться в навколишньому середовищі.
Найнебезпечнішими для металів компонентами довкілля є кисень O2 , водяна пара H2O, карбон (IV) оксид CO2, сульфур (IV) оксид SO2 та нітроген (IV) оксид NO2.
Хімічні процеси, що відбуваються під час корозії заліза:
2Fe+ H2O + O2 = 2 Fe(OH)2
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Сумарне рівняння корозії цинку:
2Zn + O2 + 2H2O = 2Zn(OH)2
Чим більше забруднене середовище, тим швидкість корозії більша. У промислово розвинутих містах метали кородують швидше, ніж у сільській місцевості.
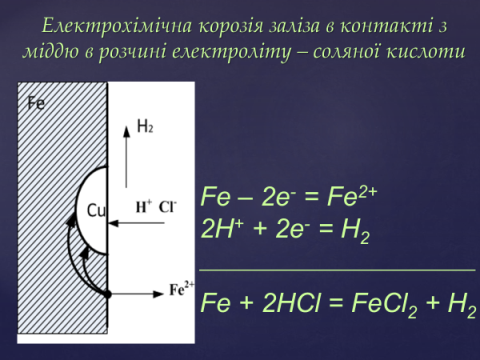
Електрохімічна корозія – це процес, який протікає за наявності 2-3 металів у середовищах з йонною провідністю. На аноді (більш активному металі) відбувається окиснення цього металу, на катоді (менш активному металі) – відновлення водню. Наприклад, для пари Zn - Cu в агресивному середовищі виникає процес
![]()
![]()
У цьому випадку активніший метал швидше руйнується.
Деякі метали при корозії покриваються щільною, добре скріпленою з металами оксидною плівкою, яка не дозволяє кисню і воді проникнути в більш глибокі шари і тому оберігає метал від подальшого окиснення. Наприклад, алюміній покривається плівкою алюміній оксиду, який захищає метал від дії кисню і води.
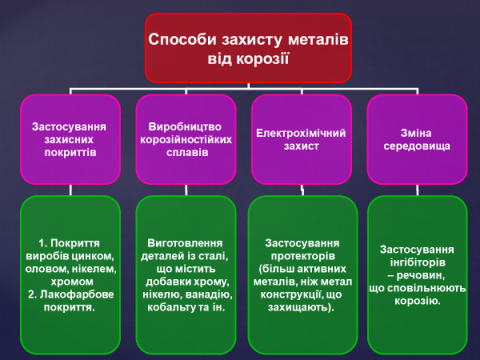
Захист металів від корозії.
. Проблема захисту металічних виробів виникла майже з початку використання металів. Люди прагнули захистити метали від атмосферного впливу за допомогою жиру, масел, а пізніше покриттям іншими металами. Так, у працях давньогрецького історика Геродота (5ст. до н.е.) є згадки про використання олова для захисту заліза від корозії.
Заходи захисту металів.
- Нанесення на поверхню металів захисних плівок (лаку, фарби, емалі).
- Покриття металів шаром інших металів. У повсякденному житті людина найчастіше зустрічається з покриттям заліза цинком і оловом. Залізо, покрите цинком, називають оцинкованим. Його використовують для покриття дахів будинків. А вкрите оловом називають білою жерстю й використовують для виготовлення консервних банок. Лудіння – покриття оловом.
- Використання інгібіторів. Інгібітори — це речовини, здатні уповільнювати процес окиснення металу.
- Створення сплавів з антикорозійними властивостями, наприклад, нержавіючих сталей шляхом додавання до заліза нікелю, хрому, кобальту тощо.
- Протекторний захист — створення контакту металу з більш активним металом, який буде руйнуватися. Так, цинк електрохімічно захищає залізо від корозії.
Готуючись до сьогоднішнього уроку ви отримали випереджувальні завдання і утворили дослідницькі групи, отже зараз ми послухаємо ваші звіти про виконану роботу.
Група №1.
Виступ учнів із захистом проекту Дослідження умов швидкості корозії.
В шість пробірок на декілька днів розмістили залізні цвяхи:
- Пробірка № 1 – залізний цвях у водопровідній воді.
- Пробірка № 2 – залізний цвях у розчині натрій хлориду.
- Пробірка № 3 – залізний цвях у контакті з міддю у розчині натрій хлориду.
- Пробірка № 4 - залізний цвях у контакті з цинком у розчині натрій хлориду.
- Пробірка № 5 – залізний цвях у розчині натрій хлориду з добавкою натрій гідроксиду.
- Пробірка № 6 - залізний цвях покритий лаком.
Результати нашого експерименту показали:
- У пробірці під №1 залізо поржавіло не сильно. Корозія в чистій воді відбувається повільніше це пояснюється тим, що вода є слабким електролітом.
- У пробірці під №2 - корозія відбувається швидше (наявність NаСІ).
- У пробірці під №3 швидкість корозії дуже велика - утворилось багато іржі. В цьому стакані залізний цвях разом з мідною дротиною поміщений у розчин NаСl.
- У пробірці під №4 спостерігаємо корозію не заліза, а цинку. Тому що залізо в контакті з більш активним металом навіть у присутності NаСl залишається захищеним.
- У пробірці під №5 добавлено розчин NаОН - корозія зменшилася. Отже, NаОН сповільнює процес корозії.
- У пробірці під № 6 – корозія не відбувається, бо залізо захищене лаком.
Група №2 підготувала інформаційний листок про корозію
Кутубська колона
За 20 км від Делі (Індія) височить одна з найзагадковіших споруд світу — залізна Кутубська колона висотою 7,3 м.,вага 6,5 т, діаметр 42 см у основи та 30 см зверху. Колона була побудована на честь царя Чандрагупти ІІ. Вважалося, що у того, хто стане до неї спиною та зведе навколо неї руки, здійсняться заповітні мрії. Попри вологий і жаркий тропічний клімат на колоні немає жодної плями іржі.
Секрет полягає у складі колони: 99,7 % заліза, незначний вміст сірки і вуглецю.
Надчисте залізо практично не піддається корозії.
Трагедія яхти «Поклик моря».
На початку минулого століття на замовлення американського мільйонера була збудована шикарна яхта, «Поклик моря». Дно її було обшите монель-металом (сплав нікелю й міді), а кіль, рама та інші деталі зі сталі. Коли яхту спустили на воду, виник величезний гальванічний елемент. Наслідки були жахливі. Ще до виходу у відкрите море, яхта повністю вийшла з ладу.
Іржа на вустах.
У апокрифічній Книзі Єноха розповідається, як злий ангел Азазель "навчив жінок мистецтву підмальовувати очі й підфарбовувати губи, щоб стати красунями... І світ від цього змінився". З фарбами, правда, були проблеми. Споконвіків для губної помади використовували природні барвники: оксид заліза (сурик), сульфід ртуті (кіновар), шафран і хну. Губи єгипетських модниць пахли іржею, бо у той час вони використовували сурик, змішаний з бджолиним воском. Колір був "вирви око", а поцілунки - гіркими і навіть отруйними.
Група №3 розробила практичні поради боротьби з корозією.
1. В кузові легкового автомобіля після 3 років експлуатації виникає біля 130-150 вогнищ корозії загальною площею в декілька квадратних метрів. Корозії піддаються майже всі елементи кузова автомобіля, але в основному вона виникає на днищі і крилах.
Поради спеціаліста: ”Лікування автомобіля”:
- За допомогою наждачного паперу очистити поверхню металу від бруду та іржі.
- Нанести шпаклівку. Потім зачистити поверхню наждачним папером: спочатку грубшим, потім тоншим.
- Після цього нанести грунтівку.
- Знежирити поверхню розчинником.
- Нанести фарбу в два шари. Перший – тонкий, другий – грубший. Інтервал між ними - 6-8 хвилин. Середній час висихання фарби -2 години.\
2. Поради спеціаліста, щоб позбавитися іржавих плям на тканині.
На бавовняних, лляних і вовняних тканинах білого кольору іржаві плями видаляють за допомогою розчинів лимонної, оцтової або щавелевої кислот з розрахунку одна чайна ложка кислоти на склянку води. Можна використати і лимонний сік. Забруднену тканину потрібно занурити в нагрітий до кипіння розчин кислоти а після цього ретельно прополоскати водою з кількома краплями нашатирного спирту.
3. Як правильно зберігати інструменти і металеві вироби в домашній майстерні. Перш ніж сховати в гараж ковзани влітку або велосипед взимку потрібно змастити їх вазеліном або саморобним захисним мастилом. Для цього до 400 г гасу додати 30 г стеаринової стружки і добре перемішати.
V. Узагальнення і систематизація знань.
1. Поміркуйте, яке відро слугуватиме довше: луджене чи оцинковане і чому?
2. Поміркуйте, як впливає на металеві частини машини те, що дороги взимку по -сипають сумішшю піску і солі?
3. Бліц-опитування
- Поясніть, що таке корозія.(руйнування металів під дією факторів зовнішнього середовища)
- Поясніть на прикладі заліза, до яких втрат призводить корозія( З доісторичних часів людство виплавило близько 20 млрд. т заліза. Із них корозія (іржа) «з’їла» 14 млрд. т)
- Які види корозії ви знаєте за механізмом перебігу корозійних пошкоджень? (хімічну, електрохімічну)
- Які ви знаєте способи захисту металів від корозії? (захисні покриття,зміна складу середовища, протекторний захист)
- Чи існують метали,що здатні самі себе захистити від корозії? (Алюміній, цинк. На їх поверхні під дією повітря утворюється стійка захисна оксидна плівка)
- Що означає термін «олов’яна чума»? У чому його суть? (алотропія олова, зміна кристалічної структури металу за низьких температур)
VI. Рефлексія.
Картка самооцінки на уроці.
|
1. |
Я був на уроці уважним |
0-2 |
|
2. |
Я зрозумів тему |
0-2 |
|
3 |
Я запам’ятав нову інформацію |
0-2 |
|
4. |
Я активно працював у складі дослідницьких груп |
0-3 |
|
5. |
Я виконав тестові завдання |
0-3 |
|
|
Всього |
0-12 |
VII. Домашнє завдання.
§18, сторінка 128-131, вправа 168, 169. Складіть сексан до слова «корозія».
VIII. Підсумки уроку.
Література
- П. П. Попель, Л. С. Крикля Хімія. Підручник для 10 класу загальноосвітніх навчальних закладів. Рівень стандарту – К.: в-во «Академія», 2010. – 130 с.
- О. Г. Ярошенко Хімія. Підручник для 10 класу загальноосвітніх навчальних закладів. Рівень стандарту – К.: в-во «Грамота» , 2010. – 214 с.
- Савчин М. М. Робочий зошит з хімії, 9 клас.- Львів: ВНТЛ - Класика, 2003 –С. 92-93.
- http://pidruchnyk.com.ua/380-himiya-yaroshenko-10-klas.html
- http://urok-ua.com/konspekt-uroku-himiji-10-klas-koroziya-metaliv-zahyst-vid-koroziji/
Додатки
Слайд 1:

Слайд 2:

Слайд 3:

Слайд 4:

Слайд 5:

Слайд 6:

Слайд 7:

Слайд 8:

Слайд 9:
Слайд 10:
Слайд 11:
Слайд 12:

Слайд 13:

Слайд 14:

Слайд 15:

Слайд 16:

Слайд 17:

Слайд 18:

Слайд 19:

Слайд 20:



про публікацію авторської розробки
Додати розробку
