Урок. "Маса атома. Атомна одиниця маси. Відносна атомна маса хімічного елемента" 7 клас
Тема: Маса атома. Атомна одиниця маси.
Відносна атомна маса хімічного елемента.
Мета:
Формування предметних компетентностей:
ознайомити учнів з поняттям абсолютної та відносної атомної одиниці маси (а.о.м.);
розширити знання учнів про Періодичну систему хімічних елементів; закріпити знання про хімічний елемент, хімічну символіку;
навчити визначати відносну атомну масу за Періодичною системою хімічних елементів; сформувати навички порівнювати відносні атомні маси елементів;
розвивати хімічну мову, виховувати інтерес до хімії.
Формування ключових компетентностей:
сприяти розвитку вміння використовувати теоретичні знання для розв’язання завдань практичного характеру.
стимулювати пізнавальну діяльність учнів, формувати вміння швидко і чітко формулювати свої думки, логічно їх викладати.
матиматична грамотність — виховувати уважність під час математичних розрахунків.
Тип уроку: вивчення нового матеріалу.
Форми роботи: бесіда, опитування, розповідь, гра, робота в групах.
Обладнання та матеріали: Періодична система хімічних елементів, картки із символами для гри “Хімічне лото”, “Третій зайвий”, “Хрестики-нулеки”.
Основні поняття та терміни: маса атома, атомна одиниця маси, відносна атомна маса хімічного елементу.
Хід уроку
І. Організаційний момент.
ІІ. Актуалізація опорних знань та мотивація навчально-пізнавальної діяльності.
Перевірка засвоєного матеріалу.
А. Фронтальна бесіда
- З яких частин складається Періодична система хімічних елементів?
- Що таке період?
- Що називається групою?
- Які бувають періоди? Наведіть приклади.
- Які бувають групи, підгрупи? Наведіть приклади.
- Які елементи входять до головної підгрупи, а які до побічної?
- Яку будову має атом?
- Чому в Періодичній системі хімічних елементів дорівнює заряд ядра?
- Які частинки входять до складу ядра?
- Які частинки рухаються навколо ядра?
- Чому дорівнює число електронів в атомі?
Б. Гра з картками хімічних елементів “Хімічне лото”, робота в групах.
Опис гри.
Гра відбувається в групах по 4 учні: 1 ведучий, 3 учасники. Кожен учасник отримує картку, з переліком певних вже вивчених хімічних елементів (рекомендовано 10 елементів). Ведучий отримує мішечок із фішками всіх вивчених хімічних елементів (рекомендовано до 28 елементів). Ведучій називає елементи, учасники повинні зібрати до кінця свою картку. Хто першим правильно закриє картку той виграє.
Приклад картки:
|
Аu |
|
|
Al |
|
|
|
|
O |
|
|
|
F |
|
Cl |
|
Cu |
Ba |
H |
|
|
|
Si |
|
|
|
Ca |
В. Експерс-опитування (5 хв):
Описати будову атома з порядковим номером:
В І — 32 В ІV — 27
В ІІ — 53 В V — 78
В ІІІ — 56 В VІ — 38
Вгадай елемент за розташуванням його у Періодичній системі:
а) ІІ період, ІІІ група, головна підгрупа (В- Бор)
б) І період, VІІІ група, головна підгрупа (Не- Гелій)
в) V період, ІІ група, побічна підгрупа (Сd - Кадмій)
Г. Гра “Третій зайвий” на дошці:
Визначь який із поданих трьох елементів є зайвим?
а) Na K Fe б) Si O F
в) N P Al г) S Al Sc
Д. Гра “Хрестики-нулики” на дошці:
Виграшний шлях — елементи одного періоду.
|
K |
Cl |
Мg |
|
S |
Br |
Cu |
|
C |
F |
Fe |
ІІІ. Мотивація навчальної діяльності.
Питання:
- З яких частинок складається речовина?
- Яка маса атома?
- Чи можна на практиці її зважити, виміряти чи обчислити?
ІV. Вивчення нового матеріалу.
Ви знаєти, що елементи у Періодичній системі хімічних елементів розміщені за зростанням відносних атомних мас.
Але атоми є надзвичайно малими частинками, так чи можна зважити атом?
Понад 200 років тому вчені почали обчислювати маси атомів хімічних елементів. Виявилось, що маса атома Гідрогену, найлегшого поміж атомів, становить:
m (H)= 1,67 х 10-24 г;
а маса Сульфуру та Оксигену:
m (S)= 5,3 х 10-23 г;
m (О)= 2,67 х 10-23 г;
Поняття атомної маси запровадив Джон Дальтон у 1803 році.
Оскільки використовувати такі маленькі величини для розрахунків було незручно, запропонували використовувати не реальну, а відносну атомну масу. Тому за одиницю виміру тривалий час використовували атом Гідрогену як найлегший.
Але сьогодні за одиницю відліку в мікромирі елементарних частинок приймають величину, що називається атомна одиниця маси ( запис а.о.м.) і вона дорівнює 1/12 маси атома Карбону.
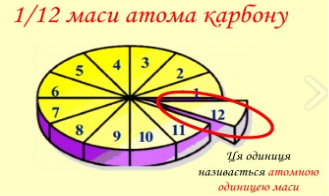

Відношення абсолютної маси атома до атомної одиниці маси називають відносною атомною масою та позначають Ar r – relative (відносний).
Вона показує, у скільки разів маса атома більша за 1/12 маси атома Карбону.
Формула для обчислення відносної атомної маси така:
Ar (E) = m атома (E) _
1/12 mатома С
Відносна атомна маса є безрозмірною величиною. Отже, у Періодичній системі для кожного хімічного елемента зазначено не реальну, а відносну атомну масу.
Обчислені за розглянутою формулою значення відносних атомних мас є порівняно невеликими й зручними в користуванні числами. Їх визначено з високою точністю.
Проте для розрахунків у хімії здебільшого використовують значення відносних атомних мас, округлені до цілих чисел.
Наприклад знайдемо деякі Ar(Е) та примінемо метод округлення:
Ar (Al) = 26,982 = 27 це означає, що маса атома Алюмінію у 27 разів більша за атомну одиницю маси.
Ar (К) = 39,098 = 39
Виключенням !!! є Хлор Ar (Сl) = 35,5
V. Узагальнення та систематизація знань.
1. Яку нову характеристику атома ми сьогодні вивчили?
2. Як обчислити відносну атомну масу?
3. Знайти в Періодичні системі хімічних елементів відносні атомні маси елементів з порядковими номерами: 15, 44, 66, 37, 11, 8.
Ar (Р) = 31; Ar (Ru) = 101;
Ar (Dy) = 163; Ar (Rb) = 85;
Ar (Na) = 23; Ar (O) = 16.
VІ. Домашнє завдання:
Параграф 6 номер 2, 3 (письмово)
-
Дуже цікавий урок. Дякую


про публікацію авторської розробки
Додати розробку
