Урок на тему «Ізотопи. Радіоактивний розпад, його небезпечність для організму»
На вивчення радіоактивності навчальною програмою виділено лише 1, що є недостатнім для повноцінного вивчення такого великого розділу хімії як радіаційна хімія. Конспект уроку включає теоретичні основи навчального матеріалу та передбачає повідомлення учнів, а також містить завдання для творчої роботи учнів по матеріалам домашньої підготовки (на що потрібно звернути увагу перед плануванням уроку).
Конспект уроку 8 класу на тему «Ізотопи (стабільні і радіоактивні). Радіоактивний розпад, його небезпечність для організму»
Мета: а) навчальна: формування знань учнів про ізотопи, про радіоактивний розпад, його небезпечність;
б) виховна: виховати в учнів вміння працювати в колективі, поважати відповіді один одного та вчителя, виховати вміння правильно вести себе на уроці та підтримувати інших;
в) розвивальна: розвинути в учнів вміння працювати з підручником, вдосконалювати хімічну мову.
Тип уроку: Урок вивчення учнями нового матеріалу та набування нових вмінь
Вид уроку: лекція з елементами бесіди
Методи: бесіда, розповідь з демонстраціями
Обладнання: таблиця «Періодична система хімічних елементів Д.І.Мендєлєєва», конспект, підручник.
План уроку
|
№ |
Етапи уроку |
Методи проведення |
Тривалість, хв |
|
1 |
Актуалізація опорних знань |
фронтальне опитування |
7 |
|
2 |
Постановка проблеми і мотивація навчальної діяльності |
розповідь вчителя |
3 |
|
3 |
Вивчення нового матеріалу |
розповідь вчителя з демонстраціями |
28 |
|
4 |
Осмислення знань |
бесіда |
5 |
|
5 |
Домашнє завдання |
розповідь вчителя |
2 |
Зміст уроку
І. Актуалізація опорних знань
1. На що вказує порядковий номер елемента? (на кількість протонів)
2. На що вказує атомна маса елементів? (це нуклонне число – сума протонів і нейтронів)
3. На що вказує період? (кількість енергетичних рівнів)
4. На що вказує група? (кількість електронів на останньому енергетичному рівні)
5. За якою формулою вираховується кількість електронів на кожному з енергетичних рівнів? (N=2n![]() )
)
ІІ. Якщо ми поглянемо на значення атомних мас будь-якого елементу, то побачимо, що це не цілочислові значення. В чому ж причина?
ІІІ. Кожний вид атома будь-якого елементу описується сумою протонів і нейтронів – нуклонним числом. По цій причині видів атомів більше, ніж елементів. Кожний окремий вид атомів називається нуклідом.
Отже, нукліди – це різновиди атомів з певним числом протонів і нейтронів.
«Нуклідом» позначають будь-які атоми, які відрізняються складом ядра. Для позначення нуклідів використовують назву елемента, до якої через дефіс приєднують нуклонне число (Оксиген-16) або ![]() .
.
Якщо нукліди належать одному й тому самому хімічному елементу і мають однакову кількість протонів, але різну кількість нейтронів, то вони називаються ізотопами.
Отже, ізотопи – це нукліди одного хімічного елемента, які мають однакове протонне число.
Вперше поняття «ізотоп» ввів в 1913 році Ф. Содді.
Наприклад, природний Оксиген містить три нукліда ![]() . Тобто, в природному Оксигені є різні види атомів, які в своєму ядрі містять однакову кількість протонів 8, але різну кількість нейтронів 8,9,10. По цій причині вони і різняться між собою атомною масою.
. Тобто, в природному Оксигені є різні види атомів, які в своєму ядрі містять однакову кількість протонів 8, але різну кількість нейтронів 8,9,10. По цій причині вони і різняться між собою атомною масою.
Ізотопи позначаються символом хімічного елемента з двома індексами ліворуч ![]() : верхній показує масове число, тобто загальна кількість нейтронів і протонів у ядрі, а нижній – абсолютне значення заряду ядра, тобто кількість протонів.
: верхній показує масове число, тобто загальна кількість нейтронів і протонів у ядрі, а нижній – абсолютне значення заряду ядра, тобто кількість протонів.
Назви і символи ізотопів збігаються з назвами і символами відповідного хімічного елемента. Винятком є ізотопи найлегшого з елементів – Гідрогену.
Хімічний елемент – це вид атомів з однаковим зарядом ядра (протонним числом).
В природі більшість хімічних елементів існує у вигляді ізотопів. Тому відносна атома таких елементів визначається величинами відносних атомних мас кожного з нуклідів з урахуванням їх масової частки в природі.
Відносна атомна маса – це середнє значення атомних мас його ізотопів з урахуванням їх масових часток у природному елементі.
Наприклад, елемент Оксиген являє собою суміш ізотопів - нуклід ![]() 99,757%,
99,757%, ![]() 0,039%,
0,039%, ![]() 0,0204%. Для знаходження атомної маси Оксигену треба:
0,0204%. Для знаходження атомної маси Оксигену треба:
![]()
Тобто загальна атомна маса Оксигену – 16.
Саме по цій причині атомні маси елементів є дробовими часлами.
Значення відкриття ізотопів зіграло важливу роль для розвитку теорії будови атома та ПЗ: 1)пояснило деякі відхилення від ПЗ, сформульованого Менделєєвим, у послідовностях зростання атомних мас хім. елементів і їх порядкових номерів (розташування елементів Ar i K, Co i Ni, Te i I); 2)дало змогу змінити це формулювання на сучасне, в якому за основу покладено не атомну масу, а заряд ядра; 3)уточнило поняття «хімічний елемент» і «відносна атомна маса елемента» в ПС.
Ізотопи поділяються на:
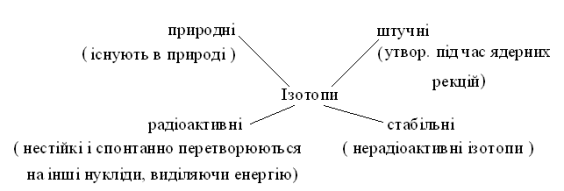
Стабільні нукліди мають усі «парні» елементи і більшість «непарних» з протонним числом < 83. Нукліди всіх елементів, розміщених у ПТ після Ві, радіоактивні.
Одним із відкриттів, що стало доказами складності будови атома є радіоактивність. Що ж це таке? Це явище випускання деякими елементами випромінювання, яке здатне проникати через речовини.
Вперше це явище у 1896р. виявив у сполуках Урана французький фізик А. Беккерель. Потім Марія Кюрі-Склодовська встановила, що радіоактивністю володіють і сполуки торія. В 1898 р. вона разом із своїм чоловіком, французьким фізиком П’єром Кюрі, відкрила в складі уранових руд два нових радіоактивних елемента, названих полонієм (Польща) і радій (промінь). І ці елементи були набагато сильнішим джерелом випромінювання за уран і торій. Хочеться відзначити, що Марія Кюрі-Склодовська – єдина жінка, двічі удостоєна Нобелівської премії (хімія і фізика).
Саме досліди подружжя Кюрі і Е. Резерфорда довели, що радіоактивне випромінювання під дією магнітного поля розділяється на три пучки: α-промені (позитивно заряджені і складаються із частин, маса яких рівна масі атома Гелія), β-промені (негативно заряджені і являють собою потік електронів) і γ-промені (електромагнітне випромінювання, подібне до рентгенівських променів і володіє значною проникною здатністю).
У процесі радіоактивного випромінювання атоми радіоактивних елементів здатні самочинно розпадатися, перетворюючись на атоми інших елементів.
Наприклад, ![]()
Радон є радіоактивним і він також випромінює електрон, перетворюючись на нуклід Францію-222 і т.д.: ![]()
Такі реакції називають ядерними. Ядерні реакції – процеси радіоактивного розпаду, під час яких відбувається перетворення одних атомів на інші.
Кожен радіонуклід має свою швидкість радіоактивного розпаду, яка називається періодом напіврозпаду. Він показує протягом якого часу розпадеться половинна початкової кількості радіонукліда. Період напіврозпаду – інтервал часу, протягом якого кількість радіоактивних атомів даного елемента зменшується вдвічі.
Однією з відкривачів в галузі радіаційної хімії є Марія Склодовська-Кюрі. Прослухаємо повідомлення про її життєвий шлях. (Повідомлення учнів)
Творче завдання:
Група 1. Радіоактивність – це добро чи зло?
Група 2. Чи можливо вплинути на рівень радіоактивності?
ІV. Опитування:
- Що таке радіоактивний розпад?
- Що таке ізотопи? Назвати їх види.
- Назвати вчених, що займалися вивченням радіаційної хімії?
- Що таке радіоактивність?
- Який вплив здійснює радіоактивність на організм людини?
- Д/з:
- Література:
- Буринська Н. М. Хімія, 8 кл.: Підручник для серед. загальноосвіт. шк./Н. М. Буринська – Київ; Ірпінь: ВТФ «Перун», 2008. – 200с.;
- Сухан В. В. Хімія: Посібник для вступників до вузів / В. В. Сухан, Т. В. Табенська, А. Й. Капустян – К.: Либідь, 1993. – 408 с.;
- Глинка Н. Л. Общая химия / Н. Л. Глинка. – М.: Химия, 1975. – С. 54 – 59.
Опорні матеріали для творчого завдання
Виникає запитання: радіоактивність – це добре, чи ні? При опроміненні організму виникають ураження, які проявляються чи то гострій, чи в хронічній формі променевої хвороби. Що відбувається при ураженні організму? Випромінювання діє на ДНК і РНК, знижуючи їх кількість, порушує функціонування ферментів, які беруть участь в утворенні білка і його кислот, порушує обмін речовин, послаблює захисні функції організму загалом. Захворювання вражають травну, нервову та інші системи організму. Шляхи потрапляння радіоактивних речовин є різні: через шкіру, легені, шлунково-кишковий тракт. Ще Марія Кюрі-Склодовська під час І Світової Війни за допомогою радону в госпіталях лікувала солдат від гангрени. На сьогодні за допомогою радіоактивного випромінювання лікують І і ІІ стадії раку.
Як же зменшити рівень радіоактивності? В наш час відомий ряд речовин, які володіють захисними властивостями – радіопротектори. Найкращим із них є цистин (амінокислота), який міститься в сирі, молочних напоях. Також зв’язують радіонукліди і виводять їх із організму пектини, який є буряках, яблуках, сливах, моркві і у всіх видах цитрусових. Для профілактики використовують хітин, який міститься в нерибних морських продуктах (краби, креветки, морська капуста).


про публікацію авторської розробки
Додати розробку
