Урок на тему "Оцтова кислота"
ОЦТОВА КИСЛОТА, ЇЇ ВЛАСТИВОСТІ ТА ЗАСТОСУВАННЯ
Розробка уроку
Мета: дати відомості про молекулярну та структурну формули оцтової кислоти, функціональну карбоксильну групу карбонових кислот, а також про фізичні та хімічні властивості оцтової кислоти і її застосування; розвивати вміння складати рівняння реакцій, що характеризують хімічні властивості оцтової кислоти; розуміти суть і типи записаних реакцій; формувати вміння працювати у групі; виховувати почуття взаємодопомоги та інтерес до предмета.
Тип уроку: урок вивчення нового матеріалу.
Форма уроку: урок-дослідження.
Методи навчання: пояснювально-ілюстративні (розповідь, бесіда); наочні — лабораторний дослід; репродуктивні.
Обладнання і реактиви: мультимедійна дошка, інструкція до лабораторного досліду; штатив із пробірками, розчини оцтової та хлоридної кислот, лакмус, метилоранж, фенолфталеїн.
Очікувані результати:
- знати:
• молекулярну, структурну та електронну формули оцтової кислоти;
• функціональну карбоксильну групу;
- уміти:
- складати рівняння реакцій, що характеризують хімічні властивості оцтової кислоти;
- доводити кислотні властивості оцтової кислоти дослідним шляхом.
Девіз уроку: «Щоб світ цікавий розгадати, треба хімію пізнати».
Хід уроку
І. Організаційний момент
Привітання. Побажання гарного настрою та успіхів на уроці.
Пропоную провести наш урок незвичайно. Уявімо собі, що наша школа - науково-дослідницький інститут, а кабінет хімії в ньому хімічна лабораторія. У ній працюють такі відділи: теоретична, інформаційна, фізична, експериментальна і практична хімія. Кожен відділ отримує конкретне завдання і буде звітувати про виконану роботу.
II. Актуалізація опорних знань
Запитання для теоретичного відділу лабораторії
Метод «Мозковий штурм»
Дайте відповіді на запитання.
- Що спільного між лимоном, томатом, квашеною капустою, щавлем і кефіром? (Кислий смак)
- Чому кропива подразнює шкіру? (До складу соку входить кислота.)
- Чому чай після додавання лимону світлішає? (Кислота змінює забарвлення барвника.)
- Чому кефір, ряжанка, сметана, простокваша належать до кисло-молочно продуктів? ( До їх складу входить молочна кислота.)
- Які органічні сполуки називають кислотами?
- Яка функціональна група входить до складу карбонових кислот? (Карбоксильна.)
- За якими ознаками можна класифікувати карбонові кислоти? (За радикалом, за кількістю функціональних груп, за силою.)
III. Мотивація навчальної діяльності
1.Прийом «Відстрочена відгадка».
Учитель. Ця речовина відома ще з незапам'ятних часів. Але в чистому вигляді її виділили лише в 1700 p., хоча до цього користувалися її водним розчином. Утворюється вона дуже просто — внаслідок прокисання вина. Цією речовиною заправляли один із відомих французьких салатів — вінегрет («кисле вино» по-французьки звучить «він егр»). Назвіть речовину. (Речовина — оцтова кислота)
2. Оголошення теми, мети та очікуваних результатів уроку.
(Учні записують тему)
Учитель. Нашій лабораторії прийшло державне замовлення - дослідити склад, властивості та застосування оцтової кислоти. На виконання завдання нам відводиться 45 робочих днів(45 хв.). Завдання уроку: формування компетенції дослідника. Об’єктом дослідження є оцтова кислота, а предметом дослідження – її властивості. Пропоную дослідження провести за таким планом:
- будова молекули;
- фізичні властивості;
- хімічні властивості;
- застосування.
IV. Вивчення нового матеріалу.
Інформаційний відділ прозвітує про виконану роботу.
(Випереджальне завдання. Розповідь учнів)
Банк цікавих даних
 Учений-історик. Оцтова кислота — перша із кислот, яка стала відома людству, у вигляді оцту, що утворюється під час бродіння вина. Ще більше 4000 років тому в Стародавньому Єгипті та інших країнах уміли готувати вино з виноградного соку, при скисанні якого утворюється оцет. Ним як харчовою приправою почали користуватися 3000 років тому. Тоді оцет був єдиною харчовою кислотою. Його назва ототожнювалася з уявленням про кисле та кислоти. Слова «кислий», «кислота» походять від лат. асеtum — «оцет», асіdum — «кислий».
Учений-історик. Оцтова кислота — перша із кислот, яка стала відома людству, у вигляді оцту, що утворюється під час бродіння вина. Ще більше 4000 років тому в Стародавньому Єгипті та інших країнах уміли готувати вино з виноградного соку, при скисанні якого утворюється оцет. Ним як харчовою приправою почали користуватися 3000 років тому. Тоді оцет був єдиною харчовою кислотою. Його назва ототожнювалася з уявленням про кисле та кислоти. Слова «кислий», «кислота» походять від лат. асеtum — «оцет», асіdum — «кислий».
Арабський хімік Добір ібн Гайан (VIII—IX ст.) отримав концентровану оцтову кислоту з оцту під час його перегонки.
Синтетична оцтова кислота вперше отримана Шталем у 1700 р.. а її склад установив Берцеліус у 1814 р. Вважається, що синтез оцтової кислоти, здійснений Г. Кольбе у 1845 р., був першим повним синтезом органічної сполуки з елементів.
Учений-біолог. Усім, відомо, що є хлібне дерево, шоколадне, динне... Але чи знаєте ви, що існує оцтове дерево — сумах пухнастий? Це невелике дерево або кущ до 4 м заввишки. Листки перисті, великі, зелено-сірі, восени набувають яскраво-червоного забарвлення. Сумах використовують як декоративне дерево у парках та садах. Плоди оцтового дерева містять оцтову кислоту, їх застосовують як гостру приправу до м'ясних страв.
Учений-філософ. Існує вираз «напоїти оцтом і жовчю», що означає «приносити страждання, муки, отруювати існування комусь». А ще розповідають, ніби колись у китайських крамничках продавали картину «Куштувальники оцту». На ній за цим заняттям були зображені троє мудреців: Конфуцій, Будда та Лаоцзи. У кожного на обличчі художник намалював вираз, який відповідав його ставленню до життя. Конфуцію оцет видався кислим, Будді—гірким, а Лаоцзи — солодким. Тлумачать цю картину так. Конфуцій був прихильником порядку та ієрархії, тому сприймав оцет так, як його сприймають усі. Будда уособлює ставлення до життя як безкінечного кола страждань, із якого вирвуться лише ті, хто відкине цей нікчемний суєтний світ. А Лаоцзи, засновник даосизму, посміхається: приймаючи реальність такою, яка вона є, людина зберігає в собі вічну сутність і вчиться на власних помилках.
 Працівник харчової промисловості. Столовий оцет (6—9 %-вий розчин оцтової кислоти) використовують як смакову приправу та консервант, наприклад, для виготовлення маринадів.
Працівник харчової промисловості. Столовий оцет (6—9 %-вий розчин оцтової кислоти) використовують як смакову приправу та консервант, наприклад, для виготовлення маринадів.
Оцтова кислота створює кисле середовище для знищення шкідливих бактерій. Чутливість мікроорганізмів до кислого середовища використовують при консервуванні овочів, квашенні чи маринуванні.
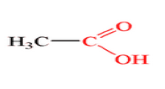
Учитель. У харчовій промисловості СН3СООН використовується як консервант і регулятор кислотності під кодом Е-260. Напишіть хімічну, структурну та електронну формули цієї речовини.
Хімічна формула:
СН3СООН – оцтова кислота (етанова);
Структурна формула оцтової кислоти:
Електронна формула оцтової кислоти:
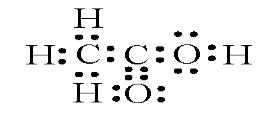
Будова молекули етанової (оцтової) кислоти. (пояснення учителя)
Структурна формула:
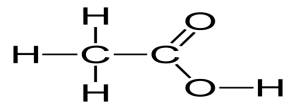
Розгляньте модель молекули в підручнику.
Зв'язок С—H — ковалентний слабкополярний, зв'язки С=0 і О—H — ковалентні сильнополярні. У результаті зміщення електронної густини подвійного зв'язку до атома Оксигену атом Карбону одержує надлишковий позитивний заряд. Через це електронна густина в гідроксильній групі значною мірою зміщена до атома Оксигену. Атом Гідрогену у зв'язку з цим легко відщеплюється у вигляді протона, зумовлюючи кислотні властивості.
2. Фізичні властивості оцтової кислоти.
(Учні самостійно виписують із підручника )
Відділ фізичної хімії звітує про свою роботу.
Фізичні властивості
Оцтова кислота — безбарвна рідина, летка, має різкий специфічний запах, змішується з водою у будь-яких пропорціях, розчин є кислим на смак.
За t < 16,7° С кристалізується («крижана кислота»)
3—9 %-й водний розчин — столовий оцет;
86 %-й водний розчин — оцтова есенція.
Температура кипіння сполуки становить +118,1 °С.
3. Дослідження хімічних властивостей оцтової кислоти
Учитель. Пропоную дослідним шляхом довести, що оцтова кислота виявляє загальні властивості кислот. Тож хочу нагадати вам, що ми працюємо у хімічній лабораторії і завжди повинні пам’ятати про техніку безпеки. Тому спочатку повторимо правила безпеки під час виконання лабораторної роботи.
Діти повторюють правила техніки безпеки і виконують експериментальні завдання, на виконання яких відводиться 5 хв.
Завдання для експериментального відділу.
Завдання 1: доведіть, що оцтова кислота виявляє кислотні властивості.
Лабораторний дослід 1. «Дія оцтової кислоти на індикатори»
У дві пробірки налийте 1—2 мл розчину оцтової кислоти і додайте кілька крапель розчинів лакмусу й метилового оранжевого.
Завдання для класу: складіть рівняння електролітичної дисоціації оцтової кислоти.
Очікувана відповідь:
![]()
![]() СН3 – СООН СН3 – СОО− + Н+
СН3 – СООН СН3 – СОО− + Н+
Завдання 2: дослідіть взаємодію оцтової кислоти з металами.
Лабораторний дослід 2. «Взаємодія оцтової кислоти з металами»
У дві пробірки налийте розчини оцтової і хлоридної кислот. В обидві пробірки додайте трохи порошку магнію. Порівняйте активність взаємодії цих кислот з магнієм.
Завдання для класу: опишіть дослід, запишіть рівняння відповідних реакцій у молекулярному та йонному виглядах.
Завдання 3: дослідіть взаємодію оцтової кислоти з лугами.
Лабораторний дослід 3. «Взаємодія оцтової кислоти з лугами»
У пробірку налийте трохи розчину лугу й додайте кілька крапель фенолфталеїну. Потім краплями додайте розчин оцтової кислоти до знебарвлення розчину.
Завдання для класу: опишіть дослід, запишіть рівняння відповідної реакції у молекулярному та йонному виглядах.
Завдання 4: дослідіть взаємодію оцтової кислоти з солями.
Лабораторний дослід 4. «Взаємодія оцтової кислоти з солями»
У пробірку налийте трохи розчину оцтової кислоти і шпателем внесіть питну соду. Спостерігайте за змінами, які відбуваються в пробірці.
Завдання для класу: опишіть дослід, запишіть рівняння відповідної реакції у молекулярному та йонному виглядах.
Учитель. Учитель. У посібнику «Хімія в нашому домі» можна прочитати таку пораду: «Щоб відновити блиск потемнілих з часом золотих і позолочених виробів, треба залишити на їхній поверхні на кілька хвилин ватний тампон, змочений в оцті, а потім промити виріб водою». Поясніть це явище, знаючи, що в ювелірному сплаві супутником золота часто є мідь, яка може окиснюватися з утворенням сполуки чорного кольору, що і надає золотим речам тьмяності.
Демонстрація. Чищення старого мідного ґудзика ватним тампоном, змоченим в оцті.
Очікувана відповідь: мідь окиснюється і утворюється купрум(ІІ) оксид чорного кольору: 2Сu + О2 = = 2СuО.
Карбонові кислоти взаємодіють з оксидами металічних елементів.
Завдання для класу: запишіть рівняння взаємодії оцтової кислоти з купрум(ІІ) оксидом у молекулярному та йонному виглядах.
Учитель. Специфічні властивості карбонових кислот Реакція естерифікації
Карбонові кислоти здатні взаємодіяти зі спиртами з утворенням естерів:
СН3СООН + НОС2Н5 -> СН3СООС2Н5 + Н20.
Реакція естерифікації відбувається у присутності сульфатної кислоти, яка в цьому випадку відіграє роль каталізатора, й гігроскопічної речовини.
Горіння
Як і більшість органічних сполук, карбонові кислоти дуже добре горять, причому чим більший вуглеводневий радикал, тим більша ймовірність протікання реакції горіння з виділенням сажі: CH3COOH+2О2 = 2CO2 + 2Н2О
Демонстрація «Полум 'я над пробіркою»
Налийте в пробірку не більше 1 мл концентрованої оцтової кислоти. Закріпіть пробірку в лапці штатива в похилому положенні, прогрійте спочатку її всю, а потім обережно нагрівайте тільки денце. Як тільки оцтова кислота закипить і її пари досягнуть виходу з пробірки, обережно підпаліть їх, краще довгою скалкою. Пари оцтової кислоти зажевріють, утворюючи довгі язики полум'я (нагрівання пробірки не припиняйте). Дослід є ефектним: створюється враження, ніби з пробірки віялом вилітають язики полум'я. З припиненням утворення пари оцтової кислоти горіння закінчується.
V. Узагальнення і систематизація знань.
Запитання для практичного відділу лабораторії.
Інтерактивна вправа «Слідство ведуть хіміки»
При введені у комп'ютер результатів лабораторних досліджень загубилися деякі формули речовин. Допоможіть визначити можливі варіанти, якщо частина інформації збереглась.
СН3СООН + … → (СН3СОО)2Са + …
… + Ва(ОН) 2 → (СН3СОО)2Ва + …
СН3СООН + СаСО3 →
К 2О + … → СН3СООК + …
СН3ОН + СН3СООН →
Розв’яжіть задачі
- Бабуся висипала соду (натрій карбонат) і кухонну сіль в однакові банки і заплуталась, куди що висипала. Як, застосовуючи властивості етанової кислоти, можна визначити, де яка речовина? Запишіть рівняння реакцій.
- Як довести наявність етанової кислоти експериментально? Яким індикатором не можна довести наявність катіону Гідрогену в розчині кислоти? Запишіть рівняння дисоціації етанової кислоти.
4. Застосування
Учень-практик. Застосування оцтової кислоти:
- Лікарські препарати;
- Запашні есенції;
- Фотоплівки;
- Ацетатна пластмаса;
- Пестициди;
- Клей ПВА;
- Ацетатне волокно, шовк;
- Приправа до їжі;
- Барвники;
- Протрава при фарбуванні тканин;
- Консервування овочів.
VІ. Підсумок уроку.
Метод «Незакінчене речення»
Сьогодні на уроці я …
Дізнався (-лася) …
Зрозумів (-ла) …
Навчився (-лася) …
Вивчив (-ла) …
Найбільші труднощі я відчув (-ла) …
Раніше я не вмів (-ла), а тепер умію…
Оцінювання роботи учнів
Учні за роботу на уроці отримують «премії»: 120 грн.(12 балів), 110 грн. (11 балів), 100 грн. (10 балів).
Учитель. Нехай ваше життя не буде кислим, як оцтова кислота і вас ніхто не «напоїть оцтом».
VІІ. Домашнє завдання
Опрацювати параграф 27, виконати вправи 238,246.
Творче завдання. Складіть сенкан про оцтову кислоту.
Список використаної літератури
- Гранкіна, Т. М. Хімія. 11 клас : Плани-конспекти уроків / Т.М. Гранкіна, А.В. Григорович. – 2003 - С.304
- Дігавцова Л.Ю. Хімія 9 клас: Плани-конспекти уроків на друкованій основі – Х: Вид-во «Ранок», 2013. - 128 с. – (Серія «Конструктор уроку»).
- Попель П.П., Крикля Л.С. Хімія 9 клас, 2009, 233 с.
- Газета «Хімія. Шкільний світ», №32 2008 р., №33 2007 р., №8 2010 р., №23 2014р.
1


про публікацію авторської розробки
Додати розробку
