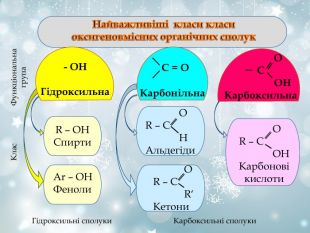
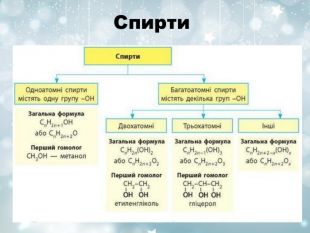
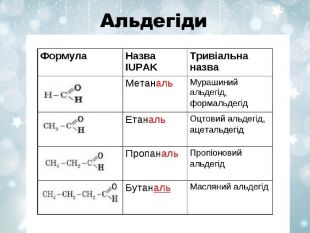
Загальна характеристика Оксигеновмісних органічних речовин


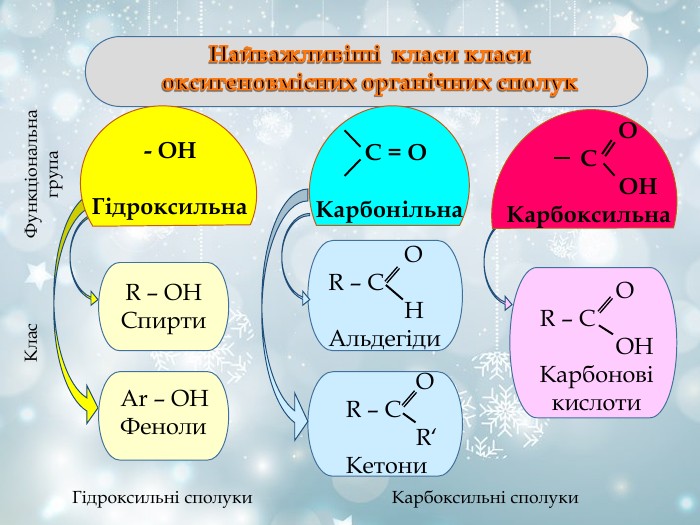
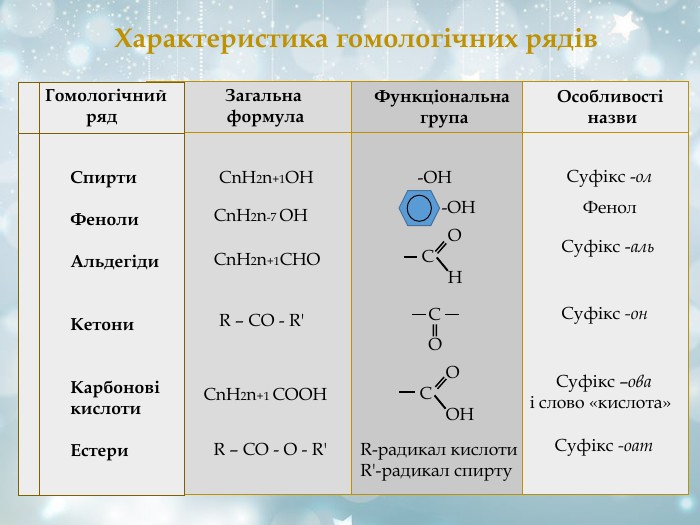



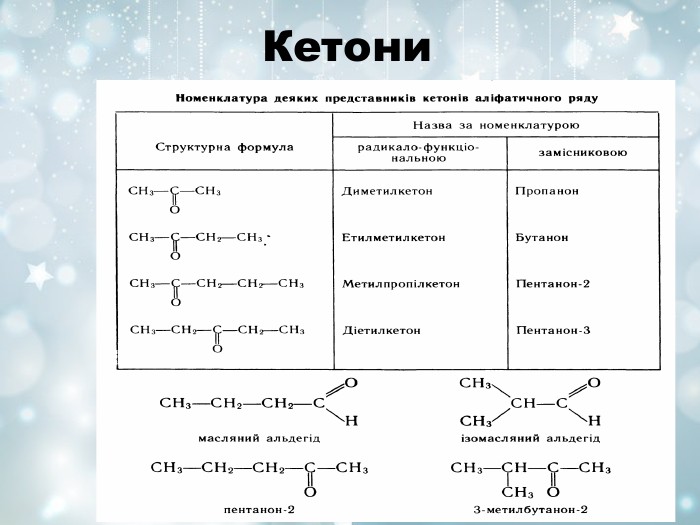





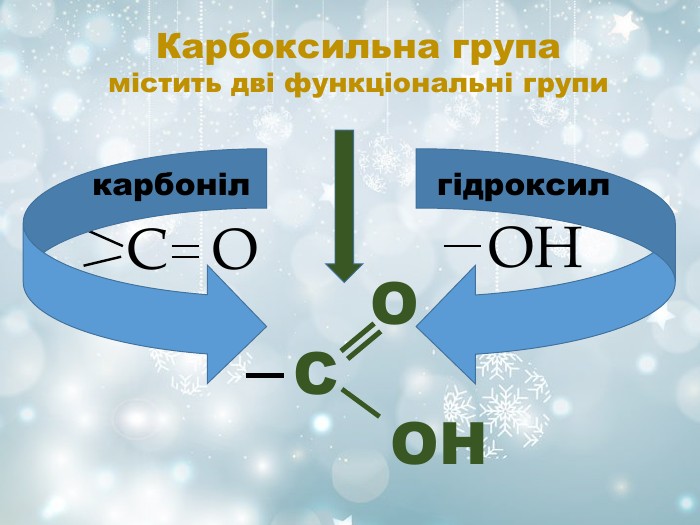


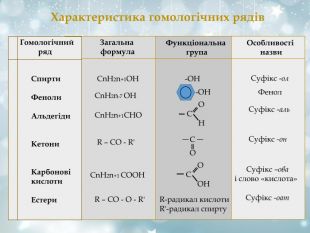
Характеристика гомологічних рядів Гомологічний ряд Загальна формула Функціональна група Особливості назви Спирти Феноли Альдегіди Кетони Карбонові кислоти Естери СnH2n+1OH -OH Суфікс -ол СnH2n-7 OH -OH Фенол СnH2n+1СHО О С Н Суфікс -аль R – CO - R' C O Суфікс -он СnH2n+1 СОOH О С ОН Суфікс –ова і слово «кислота» R – CО - O - R' R-радикал кислоти R'-радикал спирту Суфікс -оат
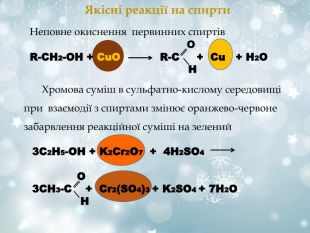
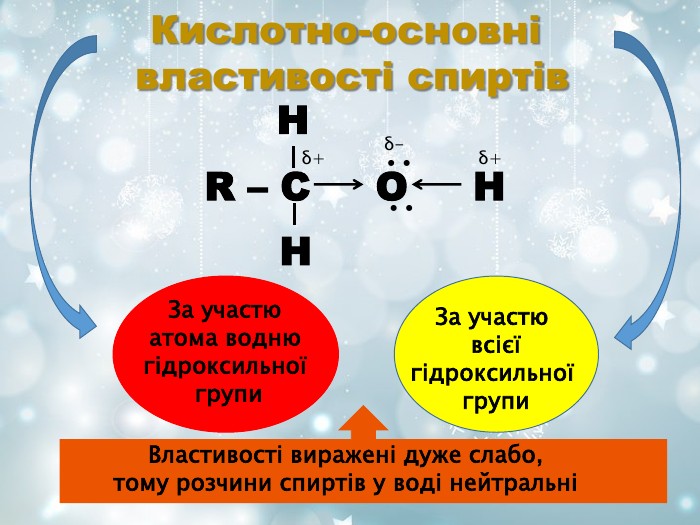
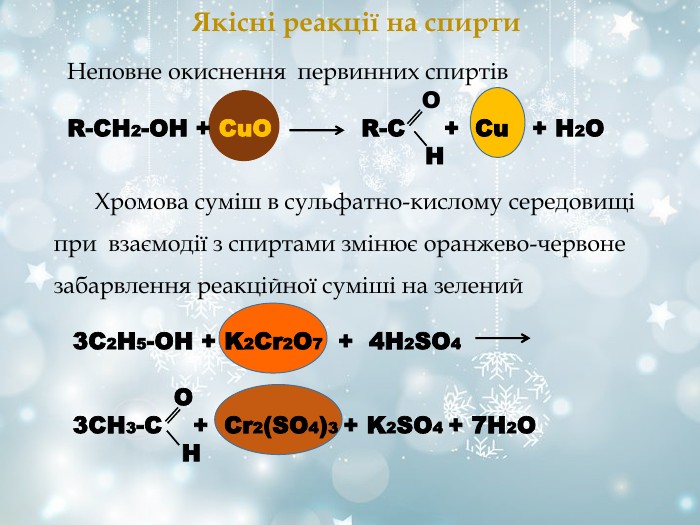
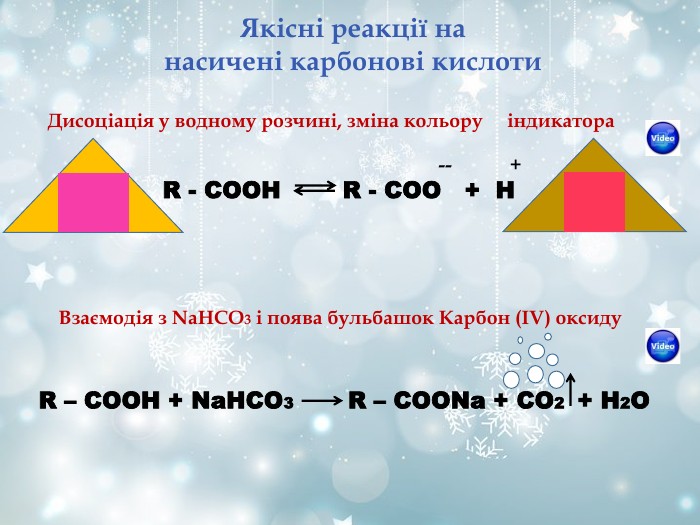
Якісні реакції на спирти Неповне окиснення первинних спиртів O R-СН2-ОН + СuО R-C + Cu + H2O H 3С2Н5-ОН + K2Cr2O7 + 4H2SO4 O 3CH3-C + Cr2(SO4)3 + K2SO4 + 7H2O H Хромова суміш в сульфатно-кислому середовищі при взаємодії з спиртами змінює оранжево-червоне забарвлення реакційної суміші на зелений
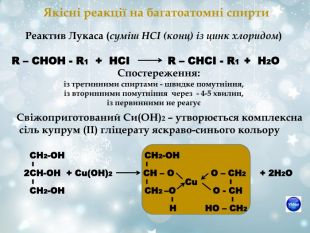
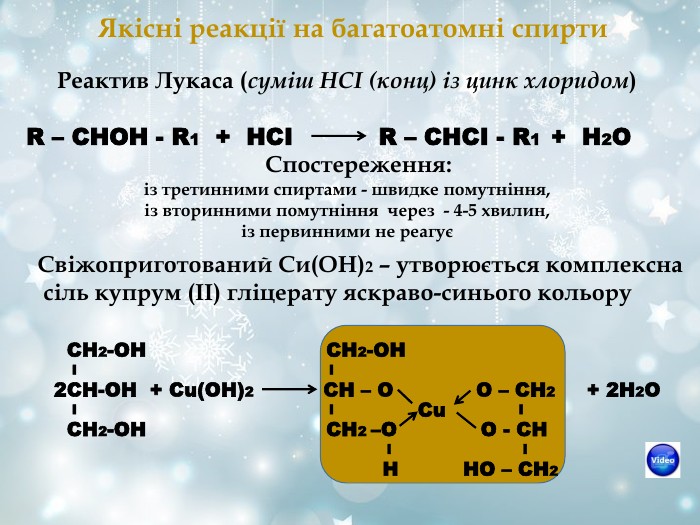
Якісні реакції на багатоатомні спирти Реактив Лукаса (суміш НСІ (конц) із цинк хлоридом) R – CHOH - R1 + HCI R – CHCI - R1 + H2O Спостереження: із третинними спиртами - швидке помутніння, із вторинними помутніння через - 4-5 хвилин, із первинними не реагує Свіжоприготований Си(ОН)2 – утворюється комплексна сіль купрум (ІІ) гліцерату яскраво-синього кольору СН2-ОН СН2-ОН І І 2СН-ОН + Сu(ОН)2 СН – О О – СН2 + 2Н2О І І І СН2-ОН СН2 –О О - СН І І Н НО – СН2 Сu
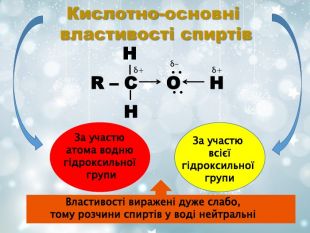
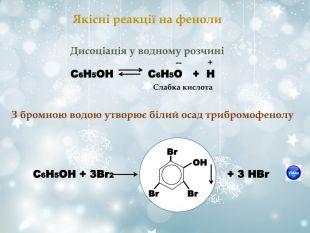
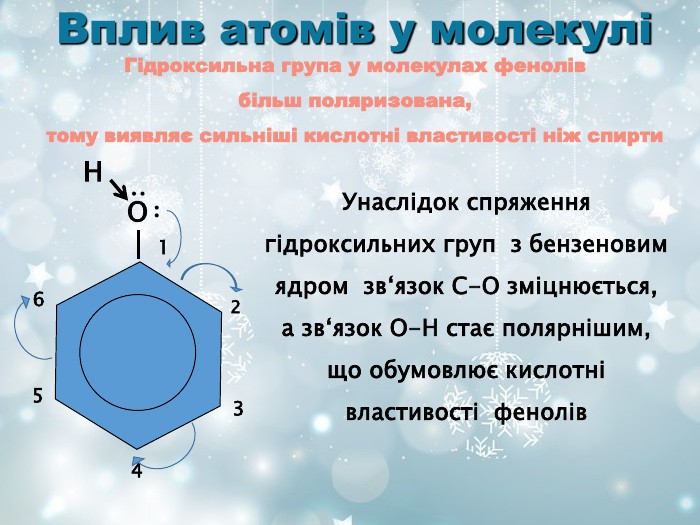
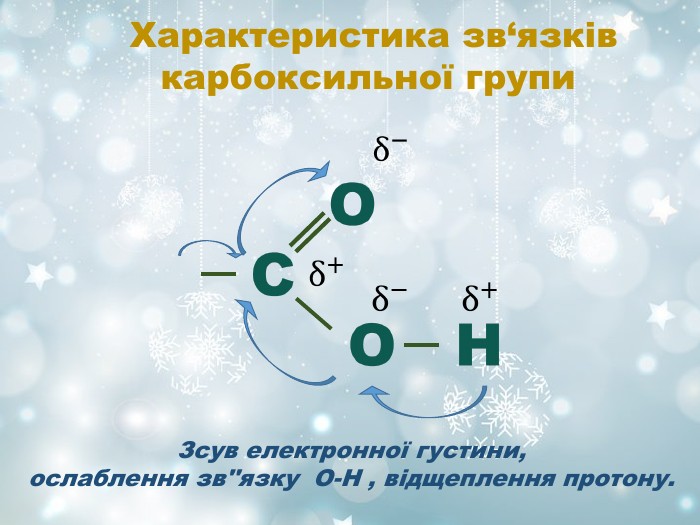
О Н ∙ ∙ ∙ ∙ 1 2 3 4 5 6 Вплив атомів у молекулі Унаслідок спряження гідроксильних груп з бензеновим ядром зв‘язок С-О зміцнюється, а зв‘язок О-Н стає полярнішим, що обумовлює кислотні властивості фенолів Гідроксильна група у молекулах фенолів більш поляризована, тому виявляє сильніші кислотні властивості ніж спирти
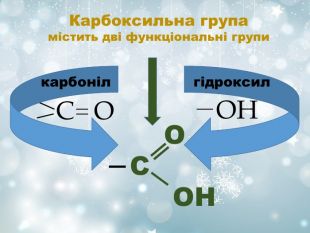
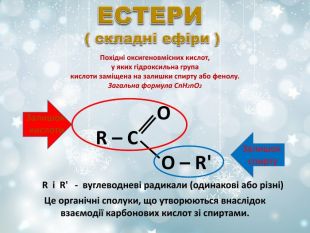
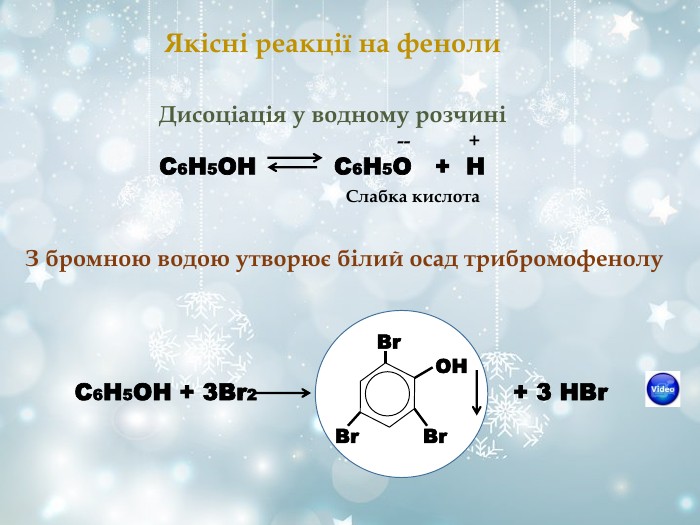
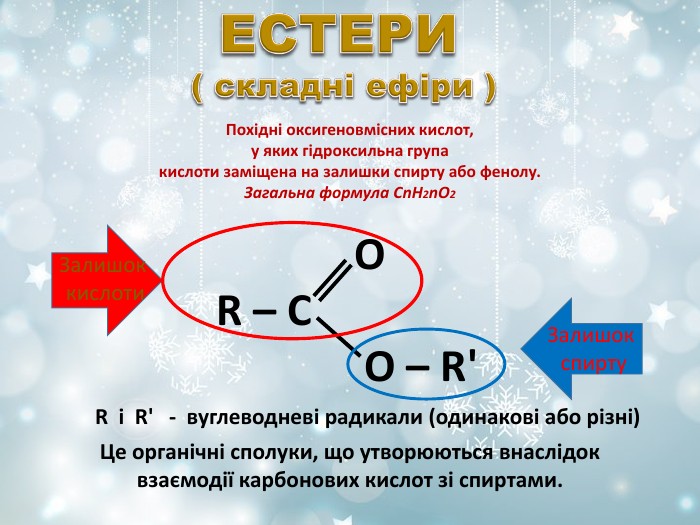
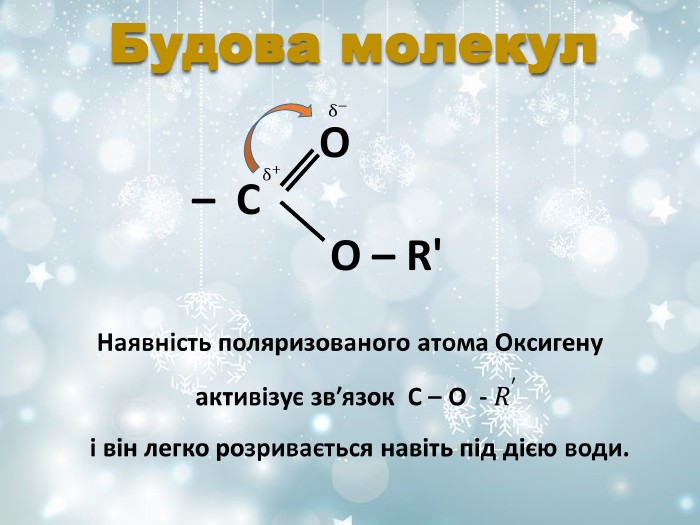
Похідні оксигеновмісних кислот, у яких гідроксильна група кислоти заміщена на залишки спирту або фенолу. Загальна формула СnH2nO2 R і R' - вуглеводневі радикали (одинакові або різні) O R – C O – R' Це органічні сполуки, що утворюються внаслідок взаємодії карбонових кислот зі спиртами. Залишок кислоти Залишок спирту
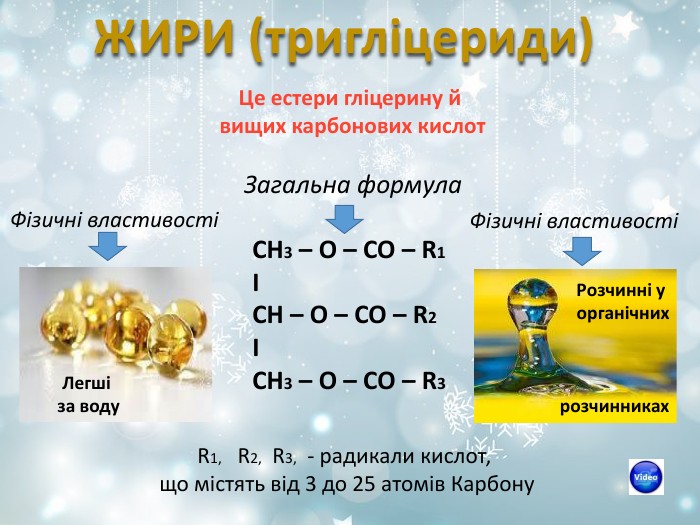
ЖИРИ (тригліцериди) Це естери гліцерину й вищих карбонових кислот Загальна формула СH3 – O – CO – R1 І СH – O – CO – R2 І СН3 – О – СО – R3 R1, R2, R3, - радикали кислот, що містять від 3 до 25 атомів Карбону Легші за воду Розчинні у органічних розчинниках Фізичні властивості Фізичні властивості
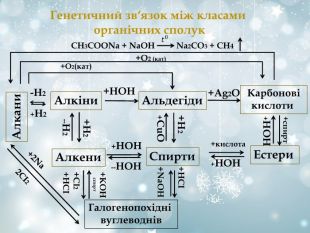
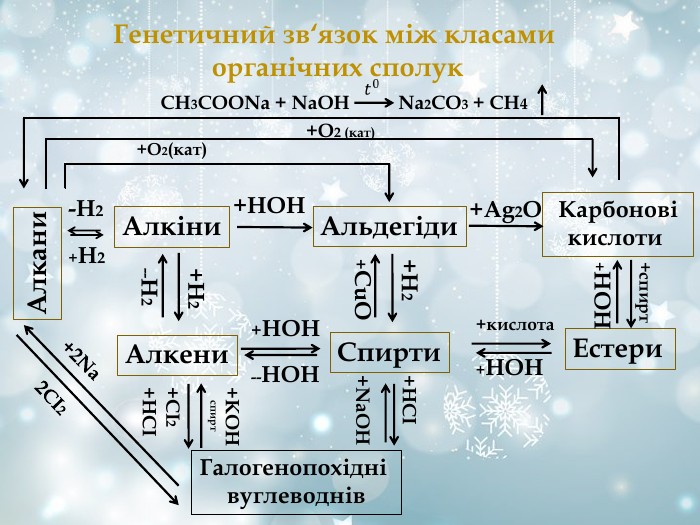
Генетичний зв‘язок між класами органічних сполук Алкени Алкіни Альдегіди Карбонові кислоти Спирти Естери -Н2 +Н2 СН3СООNa + NaOH Na2CO3 + CH4 +O2 (кат) +O2(кат) +НОН +Ag2O +Н2 --Н2 +спирт +НОН +Н2 +CuO +НСІ +NaOН +кислота +НОН +НОН --НОН Галогенопохідні вуглеводнів +KOH спирт +СІ2 +НСІ +2Na 2CI2


про публікацію авторської розробки
Додати розробку