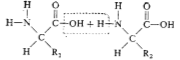Урок на тему "Рівні структурної організації білкової молекули. Фізико-хімічні властивості білків. Лабораторна робота «Реакції осадження білків при нагріванні"
Тема. Рівні структурної організації білкової молекули. Фізико-хімічні властивості білків. Лабораторна робота «Реакції осадження білків при нагріванні, концентрованими неорганічними кислотами, органічними розчинниками». Слайд №1
Мета: сформувати в учнів поняття про рівні структурної організації білкової молекули, фактори підтримання та зміни конформації білка й фізико-хімічні властивості білків; поширенням у природі та застосуванням білків; робити логічні висновки, встановлювати причинно-наслідкові зв’язки; розвивати практичні навички; виховувати діалектичний погляд на природу. Слайд №2
Обладнання: підручник для 10 клас «Біологія», фотографії, схеми, малюнки, що ілюструють рівні структурної організації білкової молекули; мультимедійний проектор чи інтерактивна дошка, на яких можна демонструвати фактори підтримання та зміни конформації білка, фізико-хімічні властивості білків, опорні конспекти.
Основні поняття та терміни: структурна організація, первинна, вторинна, третинна, четвертинна структури білків, конформація білкової молекули.
Тип уроку: комбінований .
Методи і методичні прийоми:
1. Інформаційно- рецептивний:
а) словесний: розповідь-пояснення, опис, бесіда, повідомлення учнів, робота з підручником.
б) наочний: ілюстрація, демонстрація, ТЗН;
в) практичний: виконання практичної роботи.
Прийоми навчання: виклад інформації, пояснення, активізація уваги та мислення, одержання з тексту та ілюстрацій нових знань, робота з роздатковим матеріалом.
2. Репродуктивний.
Прийоми навчання: подання матеріалу в готовому вигляді, конкретизація і закріплення вже набутих знань.
3. Проблемно - пошуковий: постановка проблемного питання.
Прийоми навчання: постановка взаємопов’язаних проблемних запитань, активізація уваги та мислення.
Міжпредметні зв ́язки: хімія.
Структура уроку. Слайд №3
І. Організаційний етап………………………………………………………...1-2 хв.
ІІ. Актуалізація опорних знань і мотивація навчальної діяльності…………..5 хв.
ІІІ. Вивчення нового матеріалу………………………………………………..23 хв.
- Рівні структурної організації білкової молекули.
- Класифікація білків.
-
Фізико-хімічні властивості білків. Лабораторна робота «Реакції осадження білків при нагріванні, концентрованими неорганічними кислотами, органічними розчинниками».
- Фактори підтримання та зміни конформації білка.
IV. Узагальнення, систематизація та контроль знань і вмінь учнів……… ..10 хв.
V. Підбиття підсумків уроку. Рефлексія ……………………………………...3 хв.
VI. Домашнє завдання ………………………………………………………..1-2 хв.
Хід уроку
І. Організаційний етап.
Хочу побажати вам гарного уроку,
Щоб було цікаво всім нам працювати,
Щоб хотіли дуже всі відповідати.
Щоб допомагало вам вміння міркувати
І дванадцять балів легко заробляти.
ІІ. Актуалізація опорних знань і мотивація навчальної діяльності. Слайд №4
Бесіда.
- Що ви знаєте про склад білкової молекули?
- Коли та як був розшифрований амінокислотний склад білків?
- Які амінокислоти входять до складу білка?
- Які спільні властивості мають амінокислоти?
- Як радикали амінокислот впливають на хімічну природу та фізико-хімічні властивості білків?
- Чи можете ви назвати замінимі і незамінимі амінокислоти?
ІІІ. Вивчення нового матеріалу
Розповідь учителя.
Білки – це вища форма розвитку органічних сполук і найважливіша складова частина організмів. «Життя – це спосіб існування білкових тіл», - точно визначив Ф. Енгельс. Слайд №5
Уперше на наявність пептидних груп у молекулах білків вказав російський біохімік О. Данилевський (1888), пізніше німецький хімік-органік Е. Фішер.
Молекулярна маса білків величезна – від 5000 до 15-20млн. Перший білок, будову якого повністю розшифровано, - гормон підшлункової залози інсулін. Слайд №6
- Пригадайте, що ви знаєте про цю речовину?
На це пішло більше 20 років складних досліджень. Канадського лікаря-хірурга Ф. Бантина і керівника дослідження, шотландського фізіолога Дж. Мак-Леода за відкриття інсуліну в 1923 р. нагороджено Нобелівською премією. І хоча від інсуліну залежить життя людей, хворих на цукровий діабет, секрет синтезу гормону відкривати не поспішали. Один із засновників української ендокринології Коган-Ясний (1889-1958) приготував у лабораторії харківського органо-терапевтичного інституту спиртову витяжку інсуліну. Через відсутність надійних даних йому довелося, як він і писав сам, «йти на осліп, кожен свій крок перевіряти експериментом і, можливо, повторювати те, що давно вже відомо в Канаді, Англії та Франції». Так було покладено початок виробництва вітчизняного препарату для лікування діабету.
Інсулін також стимулює обмін речовин, допомагає лікувати такі хвороби, як крупозне запалення легень, дистрофію, хвороби печінки, психічні захворювання (шизофренію).
Хочу звернути вашу увагу ще на одну дуже важливу залозу внутрішньої секреції – щитоподібну. І якщо статистика стверджує, що на діабет хворіють незалежно від віку і місця проживання, то захворювання щитоподібної залози найпоширеніші в Україні.
- Подумайте, які на це причини? (аварія на ЧАЕС, ендемічне захворювання).
Гормон щитоподібної залози – білок, який має четвертинну структуру, як і гемоглобін крові, тільки замість іонів Феруму має у своєму складі іони Йоду. Саме нестача цих іонів і спричиняє зниження імунітету, залоза стає беззахисною і починається безперервний поділ її клітин.
Білкове походження має і гормон росу людини, який виділяється гіпофізом та регулює ріст людини.
- Пригадайте при вивченні яких систем органів ми використовували знання про білки.
Отже, про білки вам відомо багато. Сьогодні наше завдання з’ясувати, яким чином вони виконують свої функції.
- Рівні структурної організації білкової молекули. Слайд №7
Розвиток нових експериментальних методів досліджень в органічній хімії зумовив успіхи у вивченні структури білка. Розрізняють чотири рівні морфологічної організації білків. (Вивчення просторової структури білка здійснюю на основі використання підручника та опорного конспекту.) (Додаток 1)
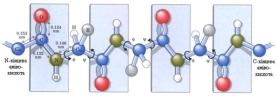
- первинна структура – визначається кількістю, якістю і порядком розміщення амінокислотних ланок у поліпептидному ланцюгу.
- Який вид зв’язку називають пептидним?
-
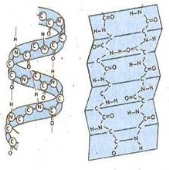
вторинна структура:
- α-спіраль – поліпептидний ланцюг закручується у спіраль, яка стабілізується водневими зв’язками (виникають між атомами Н групи =NН одного витка і О групи =СО наступного витка); така структура є остаточною для фібрилярних білків;
- β-складчастий шар – поліпептидний ланцюг укладається в складчастий шар, який стабілізується водневими зв’язками (виникають між атомами Н групи =NН і О групи =СО, що опиняються поряд); в одній молекулі можуть чергуватись ділянки з α-спіральною і β-складчастою структурою;
- третинна структура – α-спіраль або β-складчастий шар укладаються в глобулу, яка стабілізується гідрофобними взаємодіями (радикали з гідрофобними властивостями орієнтуються всередину молекули), ковалентними зв’язками –S–S– (дисульфідними містками, що виникають між радикалами цистеїну), водневими та іонними зв’язками; така структура є остаточною для більшості глобулярних білків;
- четвертинна структура – кілька глобул утворюють комплекс, який стабілізується гідрофобними і електростатичними взаємодіями, водневими та іонними зв’язками; така структура характерна для деяких глобулярних білків (наприклад, для гемоглобіну: молекула включає 2 α-глобули і 2 β-глобули, що містять відповідно по 141 і 146 амінокислотних залишків; також кожна глобула містить небілкову частину – гем).
Знаючи будову білкової молекули, можна з’ясувати властивості і функції білків. Вони обумовлені амінокислотним складом білків.
- Класифікація білків. (В процесі вивчення учні у зошиті заповнюють опорну схему.) Слайд №8
За просторовою структурою білки розрізняють:
- фібрилярні – остаточною є вторинна або ускладнена вторинна структура (спірально закручені поліпептиди можуть укладатись паралельно і «зшиватись» водневими зв’язками); нерозчинні у воді; мають велику механічну міцність; в організмі виконують в основному структурні функції (колаген, еластин, осеїн, кератин, фіброїн, міозин, актин);
- Чи можете ви навести приклади таких білків? Внесіть їх в опорну схему. (Додаток 2)
- глобулярні – остаточною є третинна або четвертинна структура; розчинні у воді (утворюючи колоїдні суспензії, утримують зв’язану воду); в організмі виконують різні функції (білки мембран, цитоплазми, ферменти, антитіла, гормони тощо);
- Чи відомі вам біологічно активні речовини із таким рівнем структурної організації?
- проміжні – мають фібрилярну природу, але розчинні у воді (фібриноген)..
- Фізико-хімічні властивості білків. Лабораторна робота «Реакції осадження білків при нагріванні, концентрованими неорганічними кислотами, органічними розчинниками».
Засвоєння матеріалу здійснюється з використанням міжпредметних зав’язків із хімією.
Ви знаєте, що білки відіграють важливу роль у побудові та обмінних процесах клітин та цілого організму.
- Чому вони такі важливі?
Часто нам важливо знати, чи наявні білки у продуктах харчування, навколишньому середовищі. Для цього ми можемо провести якісні реакції на білки або, як їх інакше називають, кольорові реакції.
Демонстрація дослідів.
- Біуретова реакція – до розчину білка додають сульфат купруму, а потім розчин лугу;
- Ксантопротеїнова реакція – до розчину білка додають по краплі концентровану нітратну кислоту.
Оскільки ксантопротеїнова реакція відбувається з використанням концентрованої нітратної кислоти, ми не можемо провести її в шкільних умовах. Демонстрацію результатів ви можете побачити на слайді. Слайд №9
Під впливом різних факторів середовища білкова молекула може змінювати свою просторову структуру. Слайд №10
Властивості білків (пояснення вчителя):
- денатурація – втрата просторової конфігурації (нативної структури), що властива білковій молекулі (при цьому можуть руйнуватись четвертинна, третинна і вторинна структури); зворотній процес;
- ренатурація – відновлення просторової конфігурації (нативної структури), що властива білковій молекулі (при цьому на основі первинної структури формуються вторинна, третинна, четвертинна); процес, обернений до денатурації;
- деструкція – втрата первинної структури білкової молекули; у більшості випадків слідує за денатурацією; незворотній процес.
Для визначення чинників денатурації білка виконаємо лабораторну роботу.
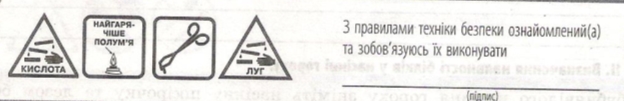
(Перед проведенням лабораторної роботи здійснюю інструктаж з БЖД.) Слайд №11
Лабораторна робота №9 (Додаток 3)
Тема. Реакції осадження білків при нагріванні, концентрованими неорганічними кислотами, органічними розчинниками.
Мета: вивчити реакції на білки, що ґрунтуються на осадженні спеціальними реактивами; вивчити процес денатурації білка, його причини.
Виконання лабораторної роботи здійснюється згідно інструктивної картки.
Підсумок лабораторної роботи аналізую разом з учнями. Слайд №12
- Як можна пояснити результати дослідів?
- Як ви гадаєте, що відбувається зі структурами білкової молекули в цих випадках?
Під час бесіди учні з допомогою вчителя характеризують процес денатурації, обговорюють фактори денатурації та її наслідки для клітини й організму.
IV. Узагальнення, систематизація та контроль знань і вмінь учнів. Слайд №13, 14
Для закріплення знань і вмінь учнів, пропоную здійснити тестову перевірку навичок, здобутих на уроці, (Додаток 4) Після тестування учні здійснюють самоперевірку. Слайд №15
V. Підбиття підсумків уроку
Бесіда про те, що нового дізналися учні на уроці. Слайд №16
- Які основні ознаки живого пов’язані з властивостями живого?
- Поясніть, чому руйнування просторової структури білкових молекул спричиняє значні змінив їх властивостях?
(Коригую й доповнюю відповіді учнів.)
Підбиваючи підсумки уроку, відзначаю учнів, які найактивніше працювали, виступали з повідомленнями, давали відповіді на запитання.
VI. Домашнє завдання: Опрацювати 22, 23 параграфи підручника; подумайте і дайте відповідь на питання «Чому під час застуди медики не рекомендують знижувати температуру до 38С», підготувати повідомлення на одну з тем «Значення білків у життєдіяльності організмів», «Білки – основа життя».
Слайд №17
Додаток 1
Опорні конспекти
Рівні структурної організації білкових молекул:
|
Структура білка |
Чим характеризується |
|
Первинна
|
Залежить від порядку чергування амінокислот у ланцюзі. Саме це визначає особливі фізико-хімічні і біологічні властивості білка. Амінокислоти зєднуються між собою міцним ковалентним пептидним зв’язком (-СО-NH-).
|
|
альфа-спіраль, бета-шар
|
Являє собою спірально закручений білковий ланцюжок. Витки спіралі утримуються водневими зв’язками, що утворюються між СО- і NH- групами. Структура фібрилярних білків |
|
|
Виникає внаслідок закручування вторинної спіральної структури в клубок (глобулу) як якісно нове утворення. Клубок утримується гідрофобними, іонними, водневими взаємодіями. Особливу роль у стабілізації цієї структури відіграють дисульфідні звязки, що виникають між залишками амінокислоти цистеїну. Основа глобулярних білків. |
|
Четвертинна |
Формується кількома молекулами білка, які знаходяться в третинній структурі, і, взаємодіючи між собою, утворюють стійку конфігурацію. Утримують цю структуру гідрофобні, електростатичні та інші взаємодії і водневі зв’язки. |
Додаток 2
Структура білків
|
Фібрилярні :
|
Глобулярні :
|
Проміжні :
|
Еластин, осеїн, фібриноген, кератин, фіброїн, міозин, , білки мембран, цитоплазми, актин, ферменти, колаген, антитіла, гормони, тубулін.
Додаток 3
Лабораторна робота №9
Тема. Реакції осадження білків при нагріванні, концентрованими неорганічними кислотами, органічними розчинниками.
Мета: вивчити реакції на білки, що ґрунтуються на осадженні спеціальними реактивами; вивчити процес денатурації білка, його причини.
Обладнання та матеріали: пробірки, штатив для пробірок, розчини білків, розчин натрій хлориду, 1%-й і 10%-й розчини натрій гідроксиду, прилад для нагрівання, 1%-й і 10%-й розчини оцтової кислоти, концентрована нітратна кислота, органічні розчинники, 1%-й розчин яєчного білка.
Хід роботи
Завдання І. Осадження білків при нагріванні.
- У п’ять пробірок налийте по 0,5 мл. 1%-го розчину яєчного білка.
- Уміст пробірки №1 нагрівайте до появи опалесценції (помутніння розчину).
- До розчину білка в пробірці №2 обережно додайте 1 краплю 1%-го розчину оцтової кислоти та нагрійте.
Спостереження___________________________________________________________________________________________________________________________
- До розчину білка в пробірці №3 додайте 1 – 2 краплі 10%-го розчину оцтової кислоти та нагрійте.
Спостереження___________________________________________________________________________________________________________________________
- До розчину білка в пробірці №4 додайте 1 краплю 10%-го розчину натрій гідроксиду та нагрійте.
Спостереження___________________________________________________________________________________________________________________________
- До розчину білка в пробірці №5 додайте 1 – 2 краплі 10%-го розчину оцтової кислоти, 1 краплю насиченого розчину натрій хлориду та нагрійте.
Спостереження___________________________________________________________________________________________________________________________
Завдання ІІ. Осадження білків органічними розчинниками.
- Помістіть у пробірку 1 мл. 1%-го розчину білка, додайте 2 мл. органічного розчинника і перемішайте.
- Додайте кілька крапель насиченого розчину натрій хлориду.
Спостереження___________________________________________________________________________________________________________________________
Висновок. Зробіть висновок про осадження білків, відповівши на запитання.
Що теке денатурація білка, які фактори її викликають?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Які чинники зумовили денатурацію?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Додаток 4
Тести для перевірки і контролю знань.
1. Спільними групами атомів у молекулах амінокислот є:
а) -СН3, -СООН; б) -ОН, -СОН; в) -NН2, -СООН; г) -СН3, -ОН; д) -СН3, -NН2.
2. Структура білкової молекули, яка визначається якісним, кількісним складом амінокислот, їхньою послідовністю у поліпептидному ланцюгу:
а) первинна; б) вторинна; в) третинна; г) четвертинна; д) проміжна.
3. Відносна молекулярна маса певного білка:
а) є сталою величиною; б) є змінною величиною; в) залежить від умов синтезу білка.
4 . Із білків можна виділити:
а) необмежену кількість амінокислот; б) близько 20 амінокислот; в) всі існуючі в природі амінокислоти.
5. Спіралевидна просторова конфігурація, якої набуває поліпептидний ланцюг, називається :
а) первинною; б) вторинною; в) третинною.
6. Денатурація білка - це порушення:
а)первинної структури; б) вторинної структури; в) третинної та вторинної структур.
7. До ферментів належать білки:
а) з яких будуються опорні м’язи й тканини організмів; б) які транспортують поживні речовини; в) що каталізують хімічні процеси в живих організмах.
8. Для виявлення білка використовують:
а) біуретову реакцію; б) реакцію гідролізу; в) денатурацію білка.
9. Білок гемоглобін виконує в організмі людини:
а) захисну функцію; б) скорочувальну функцію; в) транспортну функцію.
10. Первинна структура білка визначається зв'язком:
а) пептидним; б) водневим; в) дисульфідним.
11. Після дії на білок деякого реактиву він набув жовтого забарвлення. Цей реактив:
а) Cu(OH)2 ; б) HNO3; в) H2SO4.
12. Кількість енергії, яка вивільняється при повному розщепленні 1 г білків:
а) 0,03 кДж; б) 0,9 кДж; в) 17,2 кДж; г) 38,9 кДж; д) 42 кДж.

про публікацію авторської розробки
Додати розробку