Урок на тему "Солі: фізичні властивості, поширеність в природі і застосування" для учнів 8 класу
Тема. Солі: фізичні властивості, поширеність в природі і застосування.
Мета: закріпити знання учнів про склад середніх солей, виробити вміння складати формули середніх солей;
розглянути фізичні властивості солей і їх поширення у природі;
розглянути використання солей;
звернути увагу учнів на солі, які найчастіше застосовуються у побуті;
розвивати логічне мислення, спостережливість, допитливість, розширювати кругозір.
Тип уроку: засвоєння нових знань.
Обладнання: проектор, презентація уроку, учнівські презентації, таблиця розчинності речовин, періодична система хімічних елементів, таблиця «Кристалічні гратки»
ХІД УРОКУ
- Актуалізація і корекція опорних знань, мотивація.
Ця речовина дала назву цілому класу сполук.
Історію цієї речовини можна порівняти з історією нафти та золота.
До першої половини ХIХ століття вона вважалася рідкісним продуктом, нерівномірно розподіленим між народами земної кулі. В Африці за неї купували рабів, золото, слонову кістку. Ще в середні віки ціна міцного робітника в Африці дорівнювала шматку цієї речовини розміром з його ступню. В Індії цю речовину можна було обміняти на сапфіри. У деяких країнах цю речовину використовували, як гроші.
За нею відправлялися чумаки в далекі краї, а в козаків вона була найціннішою. Більшість народів світу вклонялася цій речовині, як символу самого життя, вічності та сталості, благополуччя й миру.
У давнину люди приписували цій речовині священні властивості, пов’язували її з добрими духами. У багатьох країнах збереглася традиція ставити перед гостями цю речовину, як символ дружби та гостинності. Існує давня традиція зустрічати дорогих гостей хлібом та …
Отже, я думаю, що ви вже знаєте, про яку речовину йдеться…. Звичайно, це натрій хлорид або, як ми говоримо в побуті, кухонна сіль. Але сьогодні ми поговоримо не тільки про цю сіль, а й про інші солі, які широко поширені та використовуються людиною .
Пригадаймо, що таке солі.
(Відповідь учнів. Солі — речовини, до складу молекул яких входять кислотні залишки (аніони), поєднані з катіонами різного походження.)
Давайте з вами згадаємо алгоритм створення формул солей…(учні відповідають)
Тоді виконайте такі завдання…
- Складіть формули солей. Дайте назву за сучасною номенклатурою
NaNO3, Na2CO3, Na3PO4, Na2SO4, NaCl
Mg(NO3)2, MgCO3, Mg3(PO4)2, MgSO4, MgCl2
- Знайдіть відповідність між хімічними формулами та назвами солей:
|
№ з/п |
Хімічна формула солі |
Назва солі |
|
|
1 |
NaBr |
А |
Калій сульфіт |
|
2 |
CaCO3 |
Б |
Калій хлорид |
|
3 |
KCl |
В |
Натрій бромід |
|
4 |
MgSO4 |
Г |
Алюміній ортофосфат |
|
5 |
AlPO4 |
Д |
Магній сульфат |
|
6 |
K2SO3 |
Е |
Кальцій карбонат |
Відповідь: 1В, 2Е, 3Б, 4Д, 5Г, 6А
- Повідомлення теми, цілей і завдань уроку
Тема уроку. Поширення солей в природі та їхнє практичне значення.
Цілі уроку:
- Дослідити фізичні властивості солей;
- Дослідити поширення солей у природі;
- З’ясувати біологічну роль солей для живих організмів.
- Сприймання й усвідомлення учнями фактичного матеріалу.
І сьогодні ми з вами дізнаємося на скільки солі різні, де вони використовуються, яке їх біологічне значення.
Отже, починаємо…
- Що ж таке солі з точки зору хімії, яка їх будова? Які фізичні властивості?
(Робота з таблицею «Кристалічні гратки» коментування вчителя, робота учнів)
Використовуючи опрацьований матеріал припустіть, які фізичні властивості будуть мати солі (учні висловлюють свої думки)
Так, справді:
- солі мають йонні кристалічні гратки, тому за звичайних умов всі тверді з високими температурами плавлення ( робота з додатком 1 підручника, стор.240);
- різняться своєю розчинністю у воді (робота з таблицею розчинності, див. підручник);
- залежно від складу солі бувають різних кольорів (демонстраційний приклад)
- вони не мають запаху, але завдяки певним хімічним реакціям можуть іноді пахнути, наприклад, Al2S3 – має запах сірководню (тухлих яєць); солі сульфітної кислоти мають характерний запах сірчистого газу.
- Одну з властивостей названу вами перевіримо експериментально…
( вчитель проводить дослід)
А чи знаєте ви добувають солі, згадайте з курсу географії. Де на Україні розміщені родовища мінеральних солей?
(ознайомлення з нерудними корисними копалинами на карті України)
- Ознайомлення з поширенням і застосуванням солей людиною проведемо у вигляді гри «А чи знаєте ви…»
Ми з вами визначились з групами, які будуть інформувати про:
І група – Хіміки – розкажуть про солі, як хімічні речовини;
ІІ група – Біологи – допоможуть нам з’ясувати біологічну роль солей для живих організмів.
Виступ групи «Хіміків»
Х - Проводячи пошукову роботу ми багато цікавого дізналися про солі як хімічні речовини. До вашої уваги представляємо наші спостереження. І так, починаємо…
Сульфати
- Кальцій сульфат у природі часто трапляється у складі мінералу гіпсу CaSO4•2H2O За температури приблизно 150С переходить у так званий алебастр 2CaSO4•H2O, який широко використовується в будівництві, входить до складу швидкотвердіючих в’язких засобів для ізоляції зон поглинань. Кальцій сульфат – будівельний матеріал. У разі додавання до бурових розчинів у складі ангідриту CaSO4 або гіпсу надає стійкості глинистим породам, які розбуравлюютьсяАлебастр також використовується для відливу різних художніх виробів. У медицині з алебастру роблять гіпсові пов’язки, використовувані в разі перелому кісток.
- Одним із почесних сульфатів є мідний купорос. Він і засіб захисту рослин, і джерело добування міді високої чистоти. Біла дрібнокристалічна речовина. З водного розчину кристалізується у вигляді кристалогідрату синього кольору, відомого під назвою синій камінь. Мідний купорос широко застосовується для електролітичного добування міді і покриття міддю інших металів, а також у боротьбі з шкідниками сільського господарства.
- Наприклад, натрій сульфат працює у склоробній промисловості. Окрім того, натрій сульфат приймає участь у виробництві соди. Найбільші запаси натрій сульфату — у країнах СНД, а такожу США, Чилі, Іспанії.
- Не менш енергійним є алюміній сульфат. Ця сіль застосовується для очищення води, у паперові, текстильній, шкіряній галузях промисловості. Якщо вам зустрінуться написи Е-515 та Е-520 знайте, що це вже відомий нам алюміній сульфат при виконанні функцій харчової добавки.
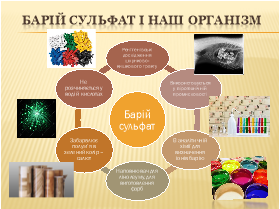
- Відомими у місті сульфатами є барій сульфат. Барій сульфат – рентгеноструктурний матеріал та наповнювач у виробництві паперу і каучуку.
Карбонати
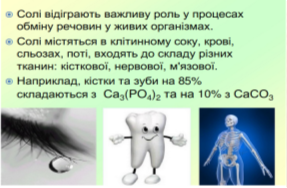
- Кальцій карбонат CaCO3 . У природі трапляється у складі вапняку, крейди, мармуру. Є сировиною для виробництва негашеного вапна CaO, використовується в металургії. Будівництво — ще один з основних споживачів CaCO3. Шпаклівки, різні герметики — усі вони містять його в значних кількостях. CaCO3 є найважливішою складовою частиною виробництва продукції побутової хімії (засобів для чищення сантехніки, кремів для взуття), товарів особистої гігієни (наприклад, зубної пасти), а також харчової та медичної промисловості.Кальцій карбонат також широко використовується в очисних системах, як засіб боротьби із забрудненням навколишнього середовища, з його допомогою відновлюють кислотно-лужний баланс ґрунту.
- Купрум(ІІ) карбонат – існує у вигляді малахіту та лазуриту – це дорогоцінні мінерали.
- Натрій гідрокарбонат – це харчова сода, використовується під час полоскань при болях у горлі як бактерицидний і протизапальний засіб; при печії (як препарат, активно нейтралізує хлоридну кислоту в шлунку); для очищення та відбілювання зубів. Широко використовується у харчовій промисловості – для випікання хлібобулочних виробів. У хімічній промисловості харчову соду застосовують для виробництва барвників, пінопластів та інших органічних продуктів,
- Калій карбонат або калій вуглекислий застосовують у всіляких галузях промисловості. Найбільше поширення він одержав: у будівництві як добавка, що забезпечує захист від впливу морозів; хімічній промисловості у виробництві мийних речовин, а також реагентів різного призначення.
Хлориди
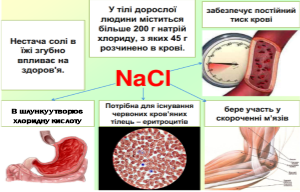
- Натрій хлорид - Історію цієї речовини можна порівняти з історією нафти та золота.
Розчини натрій хлориду широко використовують у медичній практиці як допоміжну речовину — для розчинення лікарських препаратів. NaCl — необхідна приправа до їжі, використовується для консервування харчових продуктів. Нею, навіть, можуть посипати дороги під час ожеледиці.
- Калій хлорид - Калій хлорид є поширеним калійним добривом. Крім збільшення врожайності, калійні добрива підвищують якісні характеристики вирощуваної продукції: це проявляється в підвищенні опірності рослин до захворювань, підвищенні стійкості плодів під час зберігання й транспортування, а також поліпшенні їх смакових і естетичних якостей.
Силікати
Солі також можуть бути і дорогоцінним камінням. Саму численну групу утворюють силікати, що включають топаз, циркон, гранат, турмалін і багато інших мінералів. Різні види цементу, бетону, шлакобетону, кераміки, скла, покриттів у вигляді емалей і глазурі. Це цегла, пустотілі блоки для стін, перегородок, перекриттів, облицювальні плитки, кахлі. Силікати використовуються народною медициною як речовини для знешкодження отрут. У фармації використовують як основу для приготування паст, мазей, таблеток, пілюль, як стабілізатори водних та олійних емульсій — у кремах, гелях, мазях, пастах, свічках, драже, таблетках і в технології виготовлення настоянок, екстрактів, сиропів, вакцин.
Нітрати
- Натрій нітрат NaNO3 називають натрієвою, або чилійською селітрою. Великі поклади натрій нітрату, знайдені в Чилі, очевидно, утворилися за рахунок біохімічного розкладання органічних решток. Натрій нітрат застосовують як добриво, окисник у вибухових речовинах, ракетному паливі, піротехнічних сполуках. Він застосовується у виробництві скла й солей Натрію, у тому числі нітриту, який є консервантом харчових продуктів. Натрій нітрат застосовують для готування ковбас, шинки, деяких сортів сиру й риби.
- Калій нітрат — калієва селітра. Калій нітрат — це дуже поширений компонент різних видів пороху. Чорний порох — сірий або чорно-сірий порошок, який являє собою суміш 75 % калій нітрату, 15 % вугілля й 10 % сірки. Калій нітрат — азотне добриво, багате на Калій, необхідний для росту деяких рослин.
- Амоній нітрат – амоніачна селітра використовується як добриво та для виготовлення вибухівки.
Виступ групи «Біологів» Досліджуючи роль солей для живих організмів ми отримали цікаві факти…/Робота групи по презентації…/

Вміст нітратів на 1 кг рослини:
- картопля — 250 мг;
- капуста: рання — 900 мг, пізня — 500 мг;
- морква: рання — 400 мг, пізня — 250 мг;
- томати — 150-300 мг;
- огірки — 150-300 мг;
- буряк столовий — 1400 мг;
- цибуля: ріпчаста — 80 мг, зелена — 600-800 мг;
- листові овочі (салати, шпинат, щавель, капуста, петрушка) — 2000-3000 мг;
- дині — 90 мг;
- кавуни — 60 мг;
- перець солодкий — 200-400 мг;
- кабачки — 400 мг;
- виноград столових сортів — 60 мг;
- яблука — 60 мг;
- груші — 60 мг.
- продукти дитячого харчування (консервовані овочі) — 50 р.
-
Узагальнення знань.
- Бліц – тест
1.Назвіть сіль, що складається з алюмінію та кислотного залишку сульфатної кислоти.
2.У воді родиться і води боїться.
3.Солі якої кислоти всі розчиняються уводі?
4.Тривіальна назва натрій хлориду.
5. Солі карбонатної кислоти – це …
6. Солі сульфатної кислоти-це
7. Водний розчин цієї солі має красиве рожеве-фіолетове забарвлення та допомагає у багатьох випадках – при ангінах і стоматитах, у разі харчових отруєнь, для обробки виразок та опіків. Найкращий дезінфектор. Назвіть цю сіль.
8. Хліб із … не свариться.
9. Чоловік без друга, що їжа без …
2. Виконання тестових завдань /письмова робота/
- Домашнє завдання
1. Вивчити п. 37
2. Письмово виконати завдання
№ 1, 3 , стор.206
3. Відшукати прислів’я про кухонну сіль.
- Підсумок уроку.


про публікацію авторської розробки
Додати розробку
