Урок "Нітратна кислота і нітрати, їх поширення в природі. Проблема вмісту нітратів у харчових продуктах (10клас)"
Урок на тему:
Нітратна кислота і нітрати, їх поширення в природі. Проблема вмісту нітратів у харчових продуктах (10клас), який надає можливість:
поглибити знання учнів про нітратну кислоту;
розглянути властивості нітратної кислоти;
ознайомити з солями нітратної кислоти – нітратами;
показати шкідливий вплив нітратів на здоров'я людини;
розвивати пізнавальний інтерес;
формувати вміння аналізувати, робити висновки, прогнозувати;
формувати навички самостійної роботи;
виховувати навички здорового способу життя, формуватиздоров'язбережні компетентності.
Тема уроку: Нітратна кислота і нітрати, їх поширення в природі. Проблема вмісту нітратів у харчових продуктах (10клас)
Мета:поглибити знання учнів про нітратну кислоту;
розглянути властивості нітратної кислоти;
ознайомити з солями нітратної кислоти – нітратами;
показати шкідливий вплив нітратів на здоров’я людини;
розвивати пізнавальний інтерес;
формувати вміння аналізувати, робити висновки, прогнозувати;
розвивати вміння встановлювати причинно-наслідкові зв’язки, уміння аргументувати свою відповідь;
формувати навички самостійної роботи;
виховувати навички здорового способу життя, формувати здоров'язбережні компетентності.
Тип уроку:
урок засвоєння нових знань.
Методи і прийоми:бесіда, випереджувальні завдання, робота в парах, робота зі схемами, таблицями, інтерактивні вправи ( «Мозковий штурм», «незакінчене речення»).
Базові поняття й терміни:
нітратна кислота, нітрати, ступінь окиснення.
Обладнання:
періодична система хімічних елементів Д.І. Менделєєва,
електрохімічний ряд напруг металів,
лабораторне обладнання та реактиви: зразки нітратів та солей амонію, нітратна кислота (концентрована), демонстраційні пробірки на столі вчителя; роздатковий матеріал, комп'ютер.
Хід уроку
Девіз: «Просто знати – мало.
Знання потрібно використати»
Гете
І. Організаційний момент.
Доброго дня. Я рада вас бачити в кабінеті хімії. Діти, давайте визначимо з яким настроєм ви сьогодні прийшли на урок. (Визначення емоційного стану учнів за допомогою смайликів (веселий – гарний настрій, сумний – поганий ).
На нас чекає напружена і цікава праця, а девізом нашого уроку нехай стануть слова відомого німецького поета, філософа Гете «Просто знати – мало. Знання потрібно використати».
Урок сьогодні незвичайний. До нас завітали експерти «з ближнього і дальнього зарубіжжя».
А зараз подивіться одне на одного, подаруйте одне одному посмішку. А зі своєї сторони я бажаю вам. Щоб ви були:
«У» - уважними,
«С» - старанними,
«П»- працелюбними,
«І» - ініціативними,
«Х» - хорошими учнями.
Таким чином, я вам бажаю успіху!
Отже, Щоб не мати сколіозу,
Сидіть прямо за столом,
Тримайте ноги на підлозі
Тільки під прямим кутом.
Також про зір не забувайте –
Рівно голову тримайте.
ІІ. Актуалізація опорних знань.
??? Давайте пригадаємо, що ви вивчали на попередніх уроках? (неметалічні елементи та їх сполуки.). Для кращого засвоєння наступної теми пропоную згадати ті знання, які нам будуть потрібні сьогодні.
Інтерактивна вправа.
«Мозковий штурм»
- Що вивчає наука хімія?
- За якими властивостями можна вивчати будь-яку речовину?
- Що таке оксиди?
- Як класифікують оксиди неметалічних елементів?
- Що таке гідрати оксидів?
- Що таке солі?
- Як слід поводитись з їдкими речовинами?
- Що таке індикатори?
ІІІ. Мотивація навчальної діяльності.
Речовин існує дуже багато. Але є сполука, за допомогою якої одержують багато необхідних людині речовин: добрива, без яких не можуть розвиватися рослини, вибухові речовини, ліки, барвники, пластмаси, волокна та ін. Вона – один з найважливіших окисників хімічної промисловості, може бути навіть окисником ракетного палива. Саме про цю речовину піде мова сьогодні. Як ви думаєте, якій речовині ми присвятимо наш урок? Так, ви праві. Це нітратна кислота (повідомляється тема уроку).
Нітратна кислота і нітрати, їх поширення в природі. Проблема вмісту нітратів у харчових продуктах (Запис на дошці). Давайте спробуємо визначити мету нашого уроку (відповіді учнів).
А працюватимемо ми за таким планом.
План
- Склад і будова .
- Властивості (фізичні і хімічні). Техніка безпеки.
- Добування.
- Застосування.
- Нітрати. Поширення в природі. Лабораторний дослід №6.
- Проблема вмісту нітратів у харчових продуктах.
IV.Вивчення нового матеріалу
1. Будова молекули нітратної ( азотної) кислоти
На дошці записана формула нітратної кислоти HNO3, її структурна (графічна) формула.
??? Учні визначають ступінь окиснення Нітрогену (+5). Класифікацію килоти.
Демонстрація молекули кислоти
2.Властивості
А) Фізичні властивості
(робота з підручником)
За звичайних умов чиста нітратна кислота:
- рідина - неприємний запах
- безбарвна - важча за воду
- летка - температура кипіння + 830С
- добре розчинна у воді
б) Хімічні властивості.
1. Дисоціація ( нітратна кислота – сильна кислота)
![]()
- Зміна кольору індикатора.
Демонстрація.
Дія нітратної кислоти на індикатори. (Метилоранж – рожевий, лакмус – червоний, фенолфталеїн – безбарвний).
??? За допомогою якого індикатора не можна визначати кислоти?
Схема 1. (ПРАЦЮЮТЬ УЧНІ)

- Взаємодія з основами
Mg(OH)2 + 2HNO3 → Mg(NO3)2 + 2H2O
- Взаємодія з оксидами металів
CaO + 2HNO3 → Ca(NO3)2 + H2O
- Взаємодія з солями
2HNO3 + Na2CO3 → 2NaNO3 + CO2 + H2O
Схема 2. (ВЧИТЕЛЬ)
6. Розклад нітратної кислоти. 7. Взаємодія з металами
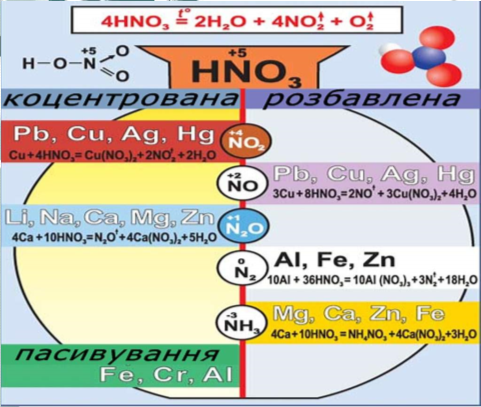
3.Добування
У лабораторії:
- Одержати нітратну кислоту можна з нітроген (ІV) оксиду:
4NO2 + O2 + 2H2O = 4HNO3
У промисловості:
її одержують каталітичним окисненням амоніаку, який, в свою чергу, утворюється в результаті сполучення водню й азоту повітря.
- У невеликих кількостях нітратна кислота може утворюватися в природі при грозових розрядах, звідси і її наявність у дощовій воді.
4. Застосування (робота з схемою). (УЧНІ)
Схема 3.
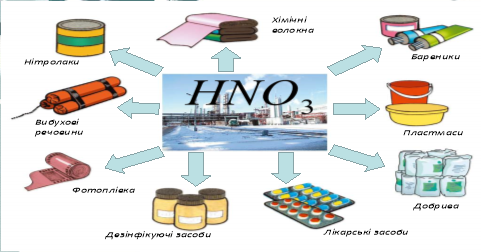
5. Нітрати. (ВЧИТЕЛЬ)
Нітрати – солі нітратної кислоти (робота з таблицею розчинності):
розчинні, токсичні, тверді кристалічні речовини. Нітрати Калію, Кальцію, Натрію, амонію – селітри. Їх призначення збагачувати грунт нітрогеновмісними сполуками.
У природі поширені рідко (ЧОМУ?) , але є на Американському континенті в Чилі, тому її і називають Чилійською селітрою.
Під час нагрівання розкладаються. (Схема 4 )
Схема № 4. Термічний розклад нітратів
ліворуч від Mg
Me(NO2)n + O2
Mg ---------Cu
![]() Me(NO3)n - MeOn + NO2 + O2
Me(NO3)n - MeOn + NO2 + O2
праворуч від Cu
Me + NO2 + O2
Лабораторна дослід. Ознайомлення із зразками нітратів.
Проводиться інструктаж з ТБ.
Виконується робота в парах, результати фіксуються в зошитах для лабораторних і практичних робіт.
- Вміст нітратів. (УЧНІ)
Питання щодо вмісту нітратів у харчових продуктах та їх впливу на здоров’я пропонується 2 учням як випереджувальне завдання. Результатом їх роботи є мультимедійна презентація і виступ перед класом .
V. Узагальнення та систематизація знань
Вправа «Незакінчене речення …»
- Ступінь окиснення Нітрогену у нітратній кислоті (+5).
- Нітратна кислота – рідина з неприємним запахом, (летка, важча за воду, ).
- Ця кислота – за основністю ----- за вмістом Оксигену __
- Взаємодіє з (основами, оксидами, солями, металами)
- З золотом, платиною (не взаємодіє ).
- У промисловості одержують (із амоніаку).
- Має широкий спектр (застосування).
- Солі нітратної кислоти – (нітрати).
- Нітрати для організму людини (шкідливі).
V. Підведення підсумків
- Сьогодні на уроці нами пророблено багато роботи, хотілося б взнати, які враження склались у вас від уроку.
- Чи досягли ви успіху? І чи справедливі слова нашого девізу? Для чого знати?
VІ. Домашнє завдання: вивчити параграф 10.
Для учнів, які навчаються на достатньому та високому рівні підготувати повідомлення про користь та шкоду мінеральних добрив.
VІІ. Оцінювання.


про публікацію авторської розробки
Додати розробку
