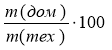Урок "ОБЧИСЛЕННЯ ЗА ХІМІЧНИМИ РІВНЯННЯМИ КІЛЬКОСТІ РЕЧОВИНИ, МАСИ АБО ОБ’ЄМУ ЗА КІЛЬКІСТЮ РЕЧОВИНИ, МАСОЮ АБО ОБ’ЄМОМ РЕАГЕНТУ, ЩО МІСТИТЬ ПЕВНУ ЧАСТКУ ДОМІШОК"
Урок №
ТЕМА. РОЗВ’ЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ. ОБЧИСЛЕННЯ ЗА ХІМІЧНИМИ РІВНЯННЯМИ КІЛЬКОСТІ РЕЧОВИНИ, МАСИ АБО ОБ’ЄМУ ЗА КІЛЬКІСТЮ РЕЧОВИНИ, МАСОЮ АБО ОБ’ЄМОМ РЕАГЕНТУ, ЩО МІСТИТЬ ПЕВНУ ЧАСТКУ ДОМІШОК.
Мета: формування предметних компетентностей: поглибити уміння розв’язувати розрахункові задачі, узагальнити та скоригувати знання учнів;
Обладнання та реактиви: періодична таблиця хімічних елементів Д.І.Менделєєва, таблиця розчинності, довідники, завдання.
Базові поняття та терміни: кількість речовини, маса, об’єм, масова частка, домішки.
Тип уроку: комбінований.
Наскрізні змістові лінії:
Підприємливість і фінансова грамотність
Обчислення за хімічними рівняннями кількості речовин, маси або об’єму за кількості речовини, масою або об’ємом реагенту, що містить певну частку домішок.
Компетентності: предметна компетентність, ключова компетентність: інформаційно-цифрова, спілкування державною мовою, екологічна грамотність і здорове життя, обізнаність та самовираження у сфері культури, математична компетентність
Хід уроку
І. Організаційний момент
Привітання, побажання гарної роботи на уроці.
ІІ. Перевірка домашнього завдання
ІІІ. Актуалізація опорних знань.
Завдання
- Запишіть формулу на визначення кількості речовини, маси та об’єму за кількістю речовини, масової частки.
ІV. Мотивація навчальної діяльності
За рівняннями реакцій можна обчислювати кількість речовини, масу або об’єм за кількістю речовини, масою або об’ємом реагенту, що містить певну частку домішок.
V. Вивчення нового матеріалу
Алгоритм розв’язування задач
Під час хімічних виробництв використовують сировину, яка в основному не являє собою чисту речовину, а містить різноманітні домішки. Ці домішки в процесі виробництва участі не беруть. Тому необхідно провести розрахунки, за якими обчислити масу чистої речовини, яка і буде брати участь в хімічному процесі.
Особливість розв’язування задач даного типу полягає в тому, що слід з’ясувати, що є технічною речовиною, чистою речовиною, а що є домішками. Технічна речовина – це речовина, в якій корисний компонент, забруднений домішками. Визначивши компоненти, користуємось опорними формулами.
Опорні формули:
m(тex) = m (чист. реч.) + m(дом.); m (чист. реч.) = m(тex) – m(дом)
W%(дом.) = ![]() ; W% (чист. реч.) =
; W% (чист. реч.) =![]()
W%(дом.) + W% (чист. реч.) = 100%
Алгоритм 1
- Записати повну і скорочену умову задачі.
- Обчислити масу домішок.
- Обчислити масу чистої речовини.
- Обчислити кількість чистої речовини.
- Обчислити за рівнянням реакції кількість продукту реакції.
- Обчислити масу чи об’єм продукту реакції.
- Записати відповідь.
Алгоритм 2
- Записати повну і скорочену умову задачі.
- Обчислити масову частку чистої речовини.
- Обчислити масу чистої речовини.
- Обчислити кількість чистої речовини.
- Обчислити за рівнянням реакції кількість продукту реакції.
- Обчислити масу чи об’єм продукту реакції.
- Записати відповідь.
Задача 1
Який об’єм водню виділиться при дії етанолу на технічний натрій масою 1,2 г, якщо масова частка домішок, що не реагують з спиртом, 10%.
|
Дано: |
|
|
V(H2)-? |
М(Na)=23г/моль; Vm=22,4л/моль
1. Знаходимо масу домішок? W%(дом.) =
m(дом)=
3. Обчислюємо кількість речовини натрію? n(Na)=1,08:23=0,05 (моль) 0,05 моль V-? 4. 2C2H5OH + 2Na → 2C2H5ONa + H2↑ 2 моль 1 моль 23 г/моль 22,4 л/моль ( згідно з рівнянням реакції кількість Na -2моль, а Н2 – 1 моль, отже n(Na) = 0,05:2 = 0,025моль (Н2) 5. Знаходимо об’єм водню? V(H2)= 22,4·0,025 = 0,56 (л) Відповідь: виділиться водень об’ємом 0,56 л. |
|
|
|
|
|
|
Задача 2.
Визначити масу оцтової кислоти, одержаної з спирту, який у свою чергу був добутий бродінням 200 кг технічної глюкози, масова частка нецукристих домішок у якій становить 10%.
![]() Дано: Розв’язання
Дано: Розв’язання
m(С6Н12О6 тех.)= 200кг 1. Записуємо відповідні рівняння реакцій
W(домішок) = 10% C6H12O6 2C2H5OH + 2CO2↑ (1)
![]() m(СН3СООН) - ? C2H5OH → СН3СООН (2)
m(СН3СООН) - ? C2H5OH → СН3СООН (2)
2.Знаходимо масу глюкози без домішок
100% - 10% = 90% (0,9)
m (глюкози) = 200кг · 0,9 = 180 кг
3.Знаходимо кількість речовини глюкози
n (C6H12O6) = ![]() = 180/180 = 1моль
= 180/180 = 1моль
4.Згідно рівнянь реакцій
n(C6H12O6): n(C2H5OH)=1:2 (1 рівняння)
n(C2H5OH)= 2 моль
n(C2H5OH):n(СН3СООН) =1:1 (2 рівняння)
n(СН3СООН)=2 моль
5.Знаходимо масу кислоти
m(СН3СООН) = 60*m = 60·2 = 120кг
Відповідь: маса кислоти 120кг.
Задача 3
Масова частка целюлози у деревині дорівнює 50%. Яку масу спирту можна добути під час бродіння глюкози, що утворюється при гідролізі деревних ошурок масою 729 кг? Урахувати, що спирт виділяється у реакційній системі у вигляді розчину з масовою часткою води 8%. Вихід етанолу становить 70%.
Дано Розв’язання
![]() w (C6Н10О5)n=50% (C6H10O5)n +nH2OnC6H12O6 (1)
w (C6Н10О5)n=50% (C6H10O5)n +nH2OnC6H12O6 (1)
m (д. ошур.) = 729кг C6H12O6![]() 2C2H5OH + 2CO2 (2)
2C2H5OH + 2CO2 (2)
w (Н2О) = 8% W = ![]() ; m(цел) = w(цел) ·m (дерев)
; m(цел) = w(цел) ·m (дерев)
ή (C2H5OH) = 70% 1. Знаходимо масу целюлози
![]() m(C2H5OH) - ? m(цел) = 0,5 ·729кг = 364,5 кг
m(C2H5OH) - ? m(цел) = 0,5 ·729кг = 364,5 кг
2.Знаходимо кількість целюлози
n = ![]() ; n(цел.) =
; n(цел.) = ![]() = 2,25 моль
= 2,25 моль
За рівняннями реакцій (1) і (2)
n(C2H5OH) = 2n(цел.) = 4,5 моль
3.Знаходимо масу C2H5OH
m = nM; m(C2H5OH) = 4,5 46 = 207 кг
Оскільки вихід спирту становить 70%, то маса практична спирту дорівнюватиме:
= ![]() .100% m(практична) = m(теоретична)/100%
.100% m(практична) = m(теоретична)/100%
mпр.(C2H5OH) = 0,7 207 = 144,9 кг
4. Знаходимо масу безводного спирту
W = ![]() ; m(р-ну) =
; m(р-ну) = ![]() ; m(р-ну) =
; m(р-ну) = ![]() = 157,5 кг
= 157,5 кг
Відповідь: маса безводного спирту 157,5 кг
Приклад 1.
Задача . Визначити масу оцтового альдегіду, який можна добути з 2 кг технічного
етилового спирту, що містить 15% домішок.
Дано: Розв’язання:
|
m (спирту) = 2 кг |
1. Зясовуємо масову частку чистого спирту у технічному |
|
W(спирту) = 100% - 8% = 92% (0,92) |
|
2. За рівнянням розраховуємо масу отриманого альдегіду
1840 г х г
СН3-СН2-ОН + CuO → СН3-СОН + Н2O + Cu
m(домішок)*100%
= m(суміші)
96
|
ν= 1 моль |
ν =1 моль |
З 1840 г спирту утвориться Х г альдегіду
з 46 г спирту утвориться 44 г альдегіду
Х = (1840 . 44) : 46 = 1760 г
Відповідь: m (СН3СОН) = 1760 г
ІІ. Визначення масової частки домішок у речовині
Приклад 2.
Технічний етаналь масою 2,5 г окиснили амоніачним розчином арґентум (І)
оксиду. При цьому утворилося 10,8 г металічного срібла. Обчисліть масову частку
домішок у технічному альдегіді.
Дано: Розв’язання:
m (етаналю з дом.) = 2,5 г 1. Обчислюємо за рівнянням масу чистого етаналю у
зразку
m(Аg) = 10,8 г Х г 10,8 г
Знайти: СН3-СОН + Ag2O → СН3-СООН + 2Ag↓
W (домішок) -? ν= 1 моль ν =2 моль
М =44 г/моль М=108 г/моль
m= 44 г m= 216 г
З Х г альдегіду утвориться 10,8 г срібла
з 44 г альдегіду утвориться 216 г срібла
Х = (10,8. 44) : 216 = 2,2 г
2. Оскільки маса етаналю 2,2 г, то маса домішок становить:
m (домішок) = m(суміші) - m (чистої речовини) = 2,5 г – 2,2 г = 0,3 г
3. Обчислюємо масову частку домішок за формулою:
W(дом.) = m(дом.) : m(суміші);
W(домішок) = 0,3/2,5 = 0,12 = 12%
Відповідь: W (домішок) = 12 %
VI. Завдання для самостійної роботи (закріплення умінь і навичок)
1. Визначити об’єм вуглекислого газу, який виділяється при спалюванні 500 г вугілля, що містить 8 % негорючих домішок.
2. Який об’єм карбон(ІІ) оксиду можна добути з 50 кг вугілля, масова частка негорючих домішок в якому складає 4 %?
3. Яка масова частка Карбону у вуглеці, якщо при спалюванні 210 кг вуглецю утвориться діоксин карбону об’ємом 358,4 л?
4. Визначити масу оцтової кислоти, одержаної зі спирту, який добуто внаслідок бродіння 200 кг глюкози, масова частка нецукристих домішок в якій складає 10%
5. Скільки потрібно картоплі, що містить 20 % крохмалю, для добування 92 кг етанолу?
6. Скільки етанолу можна добути з 42,5 кг глюкози, яка містить 15% домішок?
7. Який об’єм ацетилену можна добути з 200 кг кальцій карбіду, масова частка домішок в якому 5 %?
Розв’язування тренувальних вправ (робота в парах)
1. Яку масу натрій феноляту можна отримати в результаті взаємодії
технічного фенолу масою 20 г, що містить 6% домішок, з натрій гідроксидом? (23,2 г)
2. Який об’єм етену можна отримати при дегідратації 50 г спирту, що містить
8% домішок? (22,4 л)
3. На окиснення технічного етаналю масою 10 г витратили амоніачний
розчин, що містив 46,4 г арґентум (І) оксиду. Обчисліть вміст домішок у альдегіді (12%)
4. Технічний фенол масою 10 г повністю прореагував з натрієм. При цьому
утворилося 1,12 л газу. Обчисліть масову частку домішок у технічному фенолі. (6%)
5. Яку масу технічного оцтового альдегіду з вмістом домішок 20% потрібно
відновити воднем для отримання 230 г етилового спирту? (275 г)
6. Яку масу технічного етилового спирту (вміст домішок 15%) потрібно
окиснити для добування 8,8 г етаналю? (10,1 г)
 VII. Домашнє завдання
VII. Домашнє завдання
Опрацювати матеріал підручника, розв’язати задачу: визначити масову частку домішок у зразку кальцій карбіду, якщо з 200 г його було одержано 26 л ацетилену.
VII. Підсумок уроку


про публікацію авторської розробки
Додати розробку