Урок "Оборотні і необоротні реакції. Хімічна рівновага."
Тема уроку. Оборотні і необоротні реакції. Хімічна рівновага.
Мета уроку: познайомитися з класифікацією хімічних реакцій за ознакою оборотності, або напрямком протікання реакції; з’ясувати, при яких умовах реакції є необоротними; познайомитися з поняттям «хімічна рівновага»; розглянути принцип Ле Шательє та фактори, які впливають на зміщення хімічної рівноваги.
Тип уроку: урок-презентація
Обладнання та матеріали: мультимедійна презентація уроку, періодична система хімічних елементів, таблиця розчинності, ряд активності металів, картки із тестовими завданнями
Девіз уроку: «Людина освічена – та, яка знає, де знайти те, чого вона не знає». Георг Зілемель, німецький соціолог
Хід уроку.
І. Актуалізація опорних знань.
За яким ознаками класифікують хімічні реакції?
Які з класифікацій ми вивчили?
Проблемне питання. (Слайд 1)
Чи завжди хімічні реакції відбуваються в одному напрямку: реагенти → продукти реакції?
ІІ. Мотивація навчальної діяльності.
Мета уроку: (Слайд 2)
- познайомимося з класифікацією хімічних реакцій за ознакою оборотності, або напрямком протікання реакції;
- з’ясувати, при яких умовах реакції є необоротними;
- познайомитись з поняттям «хімічна рівновага»;
- розглянути принцип Ле Шательє та фактори, які впливають на зміщення хімічної рівноваги.
ІІІ. Вивчення нового матеріалу.
Тобі вже відомо, що хімічні реакції полягають у взаємодії вихідних речовин й утворенні кінцевих продуктів. Проте не слід думати, що напрямок хімічної реакції тільки один. Насправді хімічні реакції можуть відбуватися в прямому і в зворотному напрямках. (Слайд 3)
Реакція, під час якої з вихідних речовин утворюються кінцеві продукти, називається прямою реакцією. У рівнянні реакції її позначають стрілочкою, спрямованою зліва направо.
Реакція, під час якої вихідні речовини служать продуктами реакції, називається зворотною реакцією. У рівнянні реакції її позначають стрілочкою, спрямованою справа наліво.
NH4Cl(тв.) NH3(газ) + HCl(газ)
Хімічні реакції, що відбуваються у протилежних напрямках, називаються оборотними.
N2 + 3H2 2NH3
У рівняннях оборотних реакцій замість знака «дорівнює» ставлять дві протилежно напрямлені стрілки.

 Хімічні реакції є необоротними в наступних випадках: (Слайд 4)
Хімічні реакції є необоротними в наступних випадках: (Слайд 4)
- Один із продуктів, що утворюється, виходить зі сфери реакції – випадає у осад або виділяється у вигляді газу.
ВаСl2 + H2SO4 → BaSO4↓ + 2HCl
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
- Утворюється малодисоційована сполука.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- Реакція супроводжується виділенням великої кількості енергії.
С + О2 → СО2 + Q
Хімічна рівновага (Слайд 5)
Розповідь учителя з елементами бесіди.
- Розглянемо швидкість протікання прямої та зворотної реакції.
- Спочатку швидкість прямої реакції максимальна. Чому? (бо на початку реакції концентрація вихідних речовин найбільша)
- З часом швидкість прямої реакції сповільнюється. Чому? (зменшується концентрація вихідних речовин)
- Швидкість зворотної реакції спочатку мінімальна. Чому? (концентрація продуктів реакції мала)
-
 З часом швидкість зворотної реакції зростає. Чому? (збільшується концентрація продуктів реакції)
З часом швидкість зворотної реакції зростає. Чому? (збільшується концентрація продуктів реакції)
- Настає такий час, коли швидкість прямої реакції дорівнює швидкості зворотної реакції. Говорять: настає хімічна рівновага.
Стан хімічної рівноваги: скільки частинок вихідних речовин вступає в пряму реакцію, стільки саме їх утворюється в результаті зворотної реакції, тобто концентрації речовин залишаються незмінними.
- Після досягнення стану хімічної рівноваги реакції не припиняються, вони продовжуються, але ніяких змін у реакційній системі непомітно. Тому рівновагу називають динамічною.
Зміщення хімічної рівноваги. (Слайд 6)
Багато реакцій, що застосовуються в промисловості є оборотними. Тому виникає потреба керувати оборотними реакціями. Як змусити реакцію відбуватися в тому напрямку, щоб утворювалися в максимальній кількості ті речовини, які необхідні виробництву?
 Стан хімічної рівноваги може зберігатися за незмінних умов як завгодно довго, але при зміні умов рівновага зміщується.
Стан хімічної рівноваги може зберігатися за незмінних умов як завгодно довго, але при зміні умов рівновага зміщується.
У 1884 р. француз Ле Шательє виявив закономірності впливу зовнішніх умов на рівновагу оборотних реакцій. Він сформулював загальний принцип зміщення хімічної рівноваги, який названий на його честь принципом Ле Шательє.
Чинники, які впливають на стан хімічної рівноваги. (Слайд 7)
-
 Вплив зміни концентрації (Слайд 8)
Вплив зміни концентрації (Слайд 8)
- Вплив зміни температури.

(Слайд 9)
- Вплив зміни тиску. (Слайд 10)

Каталізатор не зміщує хімічну рівновагу, тому що однаково прискорює і пряму, і зворотну реакцію. За наявності каталізатора швидше встановлюється стан хімічної рівноваги. (Слайд 11)
ІV. Узагальнення й систематизація знань.
- «Загадковий дует»
(Один учень виходить до дошки, Йому на спину прикріплюють листок паперу із записаним на ньому терміном. Інший учень пояснює те, що написано, не називаючи сам термін. Якщо перший учень відгадав, про що йшла мова, він сідає за парту, на його місце виходить інший учень, якому прикріплюють інший термін. )
Терміни: 1) Оборотна реакція.
2) Необоротна реакція.
3) Хімічна рівновага.
4) Каталізатор
2. Тестові завдання
-
 (Слайд 13)
(Слайд 13)
- (Слайд 14).


3. «Мозковий штурм» (Слайд 15)
Відповідь:
- Збільшити концентрацію SO2, О2.
- Зменшити концентрацію SO3
- Підвищити тиск.
- Знизити температуру.
4. Розв’язання проблемного питання.
Художник зобразив модель динамічної рівноваги малюнком. Поясніть, якою має бути швидкість руху риби (1) порівняно із швидкістю течії (2), щоб модель правильно відбивала зміст поняття.
![]()
![]()
![]()
![]()
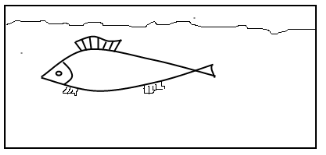
Відповідь: швидкість руху риби повинна дорівнювати швидкості руху течії.
V. Домашнє завдання.
§ 21 с.128-129 і конспект опрацювати , вправа 246 с.131


про публікацію авторської розробки
Додати розробку
