Урок "Поняття про кислотні та лужні грунти"
УРОК 48
ПЛАН-КОНСПЕКТ УРОКУ ХІМІЇ 11 КЛАС
ДАТА: _____________________
ТЕМА: Поняття про кислотні та лужні ґрунти.
МЕТА: повторити та закріпити знання учнів про кислі солі; розглянути поняття кислотності та лужності ґрунтів; порівняти кислотні та лужні ґрунти; з'ясувати якими способами можна зменшити кислотність і лужність ґрунтів; розвивати логічне мислення та увагу, продовжувати розвивати вміння написання рівнянь хімічних реакцій, порівнювати та аналізувати, узагальнювати; виховувати уважність, вміння застосовувати теоретичні знання на практиці, культуру мовлення, культуру поведінки, охайність.
ТИП УРОКУ: комбінований.
МЕТОДИ: бесіда, пояснення, виконання вправ, ігрові.
ОБЛАДНАННЯ: періодична система хімічних елементів Д.І.Менделєєва, підручник.
ХІД УРОКУ
- Організаційний етап
Привітання. Перевірка готовності учнів до уроку, відсутніх. Налаштування на роботу.
- Актуалізація опорних знань
- Які матеріали відносять до силікатних?
- Який основний компонент силікатних матеріалів?
- Які різновиди скла ви знаєте?
- Чим відрізняються різні види скла?
- Які види кераміки існують?
- Чим відрізняється цемент від скла та кераміки?
- Перевірка домашнього завдання
с. 163 завдання №2: В якому з нітратних добрив – аміачній чи кальцієвій селітрі – уміст Нітрогену більший? Ca(NO3)2 – 17%, NH4NO3 – 35%.
с. 170 завдання №2: Один із сортів скла, з якого виробляють столовий посуд, має такий склад: SiO2 – 75 %, CaO – 12 %, Na2O – 13 %. Яка кількість речовини натрій оксиду та силіцій(IV) оксиду припадає в цьому сорті скла на 1 моль кальцій оксиду? Передайте склад такого скла формулами оксидів. (6SiO2 * CaO * Na2O)
- Мотивація навчальної діяльності
Ми з вами вже розглянули солі. Знаємо, що вони бувають середніми, кислими та основними. А як це впливає на навколишнє середовище. Сьогодні ми знайдемо відповідь на це запитання. Тема нашого уроку «Поняття про кислотні та лужні ґрунти». Які завдання стоять перед нами?
- Вивчення нового матеріалу
Кислотність грунтів обумовлена присутністю в них обмінного водню та обмінного алюмінію. Джерелом йона водню в грунтах є органічні кислоти. Обмінний алюміній знаходиться в грунтах у складі солей і алюмосилікатів. У грунтах розрізняють два види кислотності: актуальну та потенційну.
Актуальна кислотність обумовлена присутністю в грунтовому розчині вільних йонів у формі Н+ і ОН-. Вона визначає реакцію грунтового розчину і характеризується величиною рН, що представляє собою негативний логарифм концентрації водневого йона. Визначення рН грунтового розчину має величезне значення, оскільки саме актуальна кислотність грунтів визначає життєдіяльність мікроорганізмів і умови існування рослин.
Потенційна кислотність показує сумарний вміст кислот і кислотних агентів в даному грунті. Ця форма кислотності визначається шляхом титрування грунтового розчину розчином лугу певної концентрації.
Реакція ґрунтового розчину. Кожний грунт має певну реакцію ґрунтового розчину, від якої залежать мікробіологічні процеси, розвиток рослин і напрям процесів грунтотворення. Реакція ґрунтового розчину в свою чергу залежить від складу увібраних катіонів і наявності в ґрунтовому розчині насамперед іонів водню, які зумовлюють кислу реакцію (дерново-підзолисті і болотні ґрунти) та гідроксильних іонів, що створюють лужну реакцію (каштанові ґрунти, сіроземи і солонці). Бувають також ґрунти з нейтральною реакцією (деякі типи чорноземів). Отже, кислотність і лужність зумовлюються наявністю в ґрунтовому розчині іонів Н+ і ОН-. У воді певна частина молекул завжди розпадається на іони Н.+ і ОН-. Залежно від температури кількість дисоційованих молекул води відносно недисоційованих завжди постійна, що схематично можна виразити рівнянням:
![]()
де Н+ - кількість іонів водню; ОН- - кількість гідроксильних іонів; Н2О – молекули води; К – постійна величина. Якщо реакція грунту кисла, то в ньому більше водневих іонів, а якщо лужна – гідроксильних. При концентрації іонів водню у дистильованій воді (без вуглекислого газу), що дорівнює 10-7, реакцію такої води вважають практично нейтральною, бо 10 т її містить лише 1 г іонів водню. Оскільки реакцію середовища визначають кількістю іонів водню в літрі води, величину її почали позначати від’ємним десятковим логарифмом величини концентрації іонів водню в ньому. Так, наприклад, якщо в літрі води концентрація іонів водню становить 0,02, то пишуть рН 2, а при концентрації ОН- - 0,00000 001 – pH 8. При нейтральній реакції один літр абсолютно чистої води містить однакову кількість іонів водню і гідроксильних іонів (10-7). Реакція середовища при цьому буде рН 7.
РОЗГЛЯНУТИ мал. 78 с.162.
Кисла реакція грунту негативно впливає на засвоєння рослинами азоту, фосфору, кальцію, магнію і сприяє надходженню в них алюмінію і марганцю. У рослинах, які ростуть на кислих грунтах, затримується перетворення моносахарів у дисахариди та інші складні сполуки та порушуються процеси утворення білків і обміну. Грунти, у яких рН менше 6, треба вапнувати. Види кислотності грунту. Розрізняють актуальну, або активну, і потенціальну, або пасивну, кислотність грунту. Актуальна кислотність зумовлюється наявністю іонів водню у ґрунтовому розчині, а потенціальна – водневих іонів і іонів алюмінію у вбирному комплексі. Актуальну кислотність ґрунтового розчину спричинюють здебільшого розчинні органічні кислоти, які утворюються в грунті внаслідок біохімічних процесів. У ґрунтовий розчин потрапляє певна кількість вуглекислого газу, який з водою утворює вуглекислоту. Потім вуглекислота дисоціює на іони Н+ і НСО3-. Іони водню також підкислюють розчин. Підкислюється ґрунтовий розчин і внаслідок розкладу гідролітично-кислих солей алюмінію й заліза, бо в розчин виділяється кислота. Потенціальну (приховану) кислотність можна виявити тільки в тому разі, якщо витиснути з вбирного комплексу увібрані іони водню. Залежно від того, якими солями визначають потенціальну кислотність, її поділяють на обмінну і гідролітичну.
Обмінна кислотність грунту зумовлюється іонами водню, які можна витиснути з вбирного комплексу розчином нейтральних солей (КСl або NaCl).
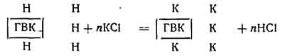
При взаємодії грунту з розчином нейтральних солей (КСl або NaCl) з вбирного комплексу катіони калію або натрію витискують не тільки увібрані іони водню, а й обмінні іони алюмінію, наприклад:
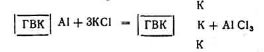
Алюміній хлорид гідролітично розщеплюється і утворює хлоридну кислоту за схемою: АlСl3 + 3Н2О ↔ Аl(ОН)3 + 3НСl. Кількість хлоридної кислоти, яка утворюється, еквівалентна кількості витісненого алюмінію. Отже, утворена хлоридна кислота і підкислює грунт. Кількість утвореної кислоти виражають у міліграм-еквівалентах (мг-екв) на 100 г грунту. Гідролітична кислотність зумовлюється наявністю у вбирному комплексі іонів водню, які витискуються катіонами гідролітично-лужних солей (рис. 29). У водному розчині натрій ацетат дисоціює на іони: CH3COONa + H2O ↔ CH3COOH+Na++OH-, внаслідок чого реакція грунту стає лужною (рН 8,2—8,4). Гідролітична кислотність завжди більша від обмінної, бо вона включає в себе актуальну і всю потенціальну кислотність. Пояснюють це явище тим, що гідролітична кислотність зумовлюється не тільки тими іонами водню, які є на поверхні колоїдної частинки, а й тими, які витискуються натрієм з інших шарів колоїдних частинок. Визначаючи гідролітичну кислотність, кількість виявлених водневих іонів також виражають у міліграм-еквівалентах на 100 г грунту. Висока кислотність грунту завжди негативно впливає на мікробіологічні процеси грунту і на розвиток рослин. Якщо реакція грунту дуже кисла (підзолисті ґрунти), то в ґрунтовому розчині, крім водню, є іони алюмінію (інколи марганцю), велика концентрація яких шкідливо впливає на розвиток рослин. Величина гідролітичної. кислотності в різних грунтах буває від 0,1 до 10 і більше мг-екв на 100 г грунту. У звичайних чорноземах гідролітичної кислотності практично немає, тоді як в опідзолених чорноземах та сірих опідзолених лісових грунтах вона інколи досягає 3 мг-екв і більше на 100 г грунту. Найбільша гідролітична кислотність у деяких торфових горизонтах болотних грунтів. Визначення кислотності грунтів має велике практичне значення. Для визначення потреби грунту у вапнуванні найчастіше користуються даними гідролітичної кислотності. Якщо остання становить 1—2 мг-екв, то грунт не треба вапнувати, а якщо вони мають більшу кислотність, то їх треба обов’язково вапнувати (слабопідзолисті піщані ґрунти вапнують навіть при гідролітичній кислотності меншій за 2 мг-екв на 100 г грунту).
Для вапнування використовують крейду, подрібнений мергель (мергель – вапняк з домішками кремнезему і глинистих речовин, а також оксиду заліза), а в районах, де розвинена цукрова промисловість, — дефекат (відходи виробництва цукру), який містить до 60—70% карбонату кальцію. На лужність грунту впливає увібраний натрій. Ступінь лужності залежить від його кількості. Якщо в грунті є обмінний натрій, то при взаємодії його з водою утворюється сода. Реакція відбувається за схемою: Грунт]NaNa +Н2О + СО2 = Грунт]НН + Na2CO3. Сода Na2CO3 у водному розчині гідролізується: Na2CO3+2H2O = 2NaOH+H2CO3. У розчині утворюється луг, реакція різко змінюється і стає лужною (рН 8-9 або навіть 10). Якщо грунт містить багато карбонатів кальцію, то при взаємодії з водою, в якій є вуглекислота, утворюються гідрокарбонати Са(НСО3)2. При цьому також реакція може змінюватися до лужної (рН 8,0—8,5). Підвищена лужність у грунті не тільки шкідливо впливає на розвиток рослин, а й підсилює пептизацію колоїдів, внаслідок чого різко погіршуються фізичні властивості, водний режим грунту тощо. Для боротьби з надмірною лужністю ґрунти гіпсують, щоб замінити увібраний натрій кальцієм. Схематично реакцію можна зобразити так: (грунт)2Na+CaSO4→(грунт)Ca + Na2SO4. Утворена сіль (Na2SO4) добре розчиняється у воді і легко вимивається з верхніх горизонтів.
Поліпшення властивостей грунтів і зниження грунтової кислотності досягаються внесенням в грунт іона Са2+ у формі вапна, меленого вапняку, крейди та інших добрив, тобто так званим вапнуванням грунту. Якщо в кислий грунт вносять вапно, протікає реакція обміну. В результаті вапнування в грунті не утворюється сполук, шкідливих для рослин. У першу чергу вапно вносять до грунту, які мають рН до 3,5, потім - від 3,5 до 4,5 і, нарешті, від 4,5 до 5,5. Вище рН = 5,5 вапнування не проводиться. Дозу вапна визначають за рН. При внесенні вапна за рН нейтралізується обмінна кислотність грунту. Для вапнування кислих грунтів лісових розсадників рекомендується вносити 2/3 дози, встановленої за рН, або половину дози, обчисленої за гідролітичною кислотністю грунту. Відразу після внесення вапна в лісових розсадниках не слід висівати насіння хвойних порід, так як вапно створює лужну реакцію середовища. У лісових культурах вапнування проводять врозкид. У перші роки спостерігається деяке зниження приросту через лужну реакції грунтів, спричинену добривом. Вапнування роблять раз на 3-5 років.
Лужність грунтів. Розрізняють актуальну і потенційну лужність грунтів. Актуальна лужність - це лужність грунтового розчину, що виникає під впливом гідролітично лужних солей, наприклад соди або бікарбонату кальцію. Потенційна лужність виявляється у грунтів, що містять в грунтовому поглинаючому комплексі натрій. Вона характерна для солонцюватих і засолених грунтів і визначається реакцією з утворенням соди. Боротьба з лужністю проводиться гіпсування грунтів. Сірчанокислий натрій водорозчинний, легко вимивається. Введення в грунтовий комплекс Са2+ покращує властивості грунтів. Для зниження лужності солонців застосовують суперфосфат, сульфат амонію, гній.
Буферність грунтів - це властивість грунту підтримувати постійну реакцію грунтового розчину. Буферність залежить від хімічного складу і ємності поглинання грунту, складу поглинених катіонів і властивостей грунтового розчину. Якщо в грунт влити трохи соляної кислоти, то можна очікувати підкислення грунтового розчину, проте цього не відбудеться, тому що відбудеться обмінна реакція з утворенням нейтральних солей. Якщо додати луг, наприклад соду, то і вона також буде нейтралізована. Буферна здатність грунтів буде тим вищою, чим більша їх ємність поглинання. На буферні властивості грунтів має великий позитивний вплив бікарбонат кальцію. Буферність - явище, яке забезпечує більш-менш постійну концентрацію водневих і гідроксильних йонів в грунті, що дає можливість рослинам пристосуватися до умов середовища.
Рослини, що вказують на кислотні ґрунти: подорожник, мох, щавель кінський, мокриця, кислиця звичайна, хвощ, жовтець повзучий. Рослини, що ростимуть на кислотних ґрунтах: малина, ожина, аґрус, і смородина, суниця садова (полуниця), чорниця, брусниця, журавлина, лохина, троянда, півонія, папороть, хризантема, волошки, незабудки, маки, гарбузові культури, томати, моркву, картоплю і зеленні культури. Рослини, що вказують на лужні ґрунти: люцерна посівна, льнянка, деревій, полин і фіалка польова. Рослини, що ростимуть на лужних ґрунтах: сливи біла і японська, тис ягідний і європейський, горобина, церцис, гібіскус, спирею, кизильник, садовий жасмин, адоніс, чемерник, гірська волошка, ломикамінь, гіпсофіла, барбарис і глід, бузина чорна і кизил, форзиція і тамариск, груша, черешня, персик, абрикос, волоський горіх, шовковиця та айва, адоніс, маренка, асфоделіна, астільба, берізка, гіпсофіла, іпомея, ряст, лаванда, сонцецвіт, нічна фіалка, хризантема і мальва, айстра, гвоздика, гіацинт, очиток, ірис, календула, канна, чемерник, котяча м'ята, матіола і дзвіночок, кукурудзу та зернові, горох, боби, огірки, бруква, капуста, полуниці, пастернак, петрушка, буряк, гарбуз, квасоля, часник і шпинат.
VІ. Узагальнення вивченого матеріалу
- Шпинат росте на слабко лужних ґрунтах. Що необхідно зробити для вирощування шпинату, якщо рН ґрунту 4,5?
- У господині виникло бажання вирощувати лохину та чорницю. Але вона не знає який ґрунт у неї на ділянці. Допоможіть визначити тип ґрунту, якщо на обійсті можна зустріти подорожник та хвощ? Як перевірити тип ґрунту? Чи зможе господиня вирощувати бажані культури?
VII. Домашнє завдання
Опрацювати §28 с.161-162, завдання № 1,3,6 с.163.


про публікацію авторської розробки
Додати розробку
