Урок "Поняття про лужні метали"
Тема. Лужні метали
Мета: поглибити знання учнів про лужні метали, удосконалювати вміння складати рівняння хімічних реакцій взаємодії металів з простими речовинами; розвивати логічне мислення; виховувати самостійність та колективізм.
Хід уроку
І Організаційний етап.
ІІ Мотивація навчальної діяльності.
(Звучить спокійна музика).
Незабаром в усьому світі відзначатимуть День закоханих. Любов може бути в різних проявах – це любов до коханих, до ближнього, до справи, якою займаєшся. Саме любов до праці робить людину щасливою, а коли людина щаслива, вона задоволена собою, впевнена в собі.
Ми знаємо, що на світі є багато невідомого. Бувають різні відкриття для всіх і для себе. Для себе – це те, чого ти раніше не знав. Бажаю, щоб сьогодні ви зробили відкриття самі для себе.
Адже ми з вами побуваємо в чудовій і загадковій країні Лужних металів. Мета нашого візиту до цієї країни познайомитись з її мешканцями та з’ясувати, що їх об’єднує та які вони мають особливості.
(На екрані слайд, на якому написані тема, мета, епіграф та девіз уроку).
Епіграф: пізнання пломінь хай не гасне, досліджуйте, що є прекрасне й велике, що не знав ще світ. М. В. Ломоносов
Девіз уроку
Думати - колективно,
Діяти оперативно,
Сперечатись доказово –
Це для всіх обов’язково!
Оцінювання на уроці буде незвичайним. В кожного на парті знаходиться картка самооцінки, в яку ви зможете поставити бали за кожне виконане завдання.
ІІІ Вивчення нового матеріалу.
Вже можна вирушати у подорож, але нам не вистачає візитки. Зараз ми її оформимо.
Візитна картка
Ім’я: Li, Na, K, Rb, Cs, Fr.
Прізвище: Лужні метали.
Місце проживання: І група, головна підгрупа періодичної системи .
(На екрані слайд «Візитна картка»).
Адресу ми вже маємо, можемо вирушати. Ви мали випереджувальні завдання. Кожна група працювала над певним питанням. Протягом уроку ви зможете розповісти про хід власних досліджень. Але спочатку пригадаємо правила, яких повинен дотримуватись учень працюючи на уроці.
- Не перебивати один одного.
- Допомагати.
- Поважати один одного.
- Слухати.
- Бути доброзичливим.
- Виконувати правило «піднятої руки».
- Кожна думка має право на існування.
- Бути активним.
(На екрані слайд «Правила роботи в групах»).
Правила ми пригадали і з почуттям ввічливості та взаємодопомоги активно та творчо продовжимо нашу роботу, перейшовши до завдань, які були поставлені перед кожною групою.
Сьогодні на уроці присутні історики, фізики, хіміки-експериментатори, кореспонденти журналів «Хімія та біологія» і «Хімія». Зараз послухаємо істориків, які цікавились історією відкриття лужних металів.
Доповідь істориків.
(На екрані таблиця «Історія відкриття лужних металів»).
Історія відкриття лужних металів
|
Хімічний елемент |
Дата відкриття хімічного елемента |
Вчений, який відкрив хімічний елемент |
Походження назви хімічного елемента |
|
Li |
1817 |
Ю.А.Арфведсон (Швеція) |
Від грец. liqoV - камінь |
|
Na |
1807 |
Г.Деві (Англія) |
Від давньоримської назви соди natron |
|
K |
1807 |
Г.Деві (Англія) |
Від арабської назви лугу, давньоримської назви поташу alkali |
|
Rb |
1861 |
Р.В.Бунзен і Г.Кірхгоф (Німеччина) |
Від кольору характерних ліній спектру rubidus – темно-червоний |
|
Cs |
1860 |
Р.В.Бунзен і Г.Кірхгоф (Німеччина) |
Від кольору характерних ліній спектру caesus – синьо-сірий |
|
Fr |
1939 |
М.Пере (Франція) |
На честь Франції |
Звичайно, коли відкрили всі ці метали, необхідно було знати і їхні властивості. Фізичними властивостями лужних металів цікавились фізики.
Доповідь фізиків.
(На екрані таблиця «Фізичні властивості лужних металів»).
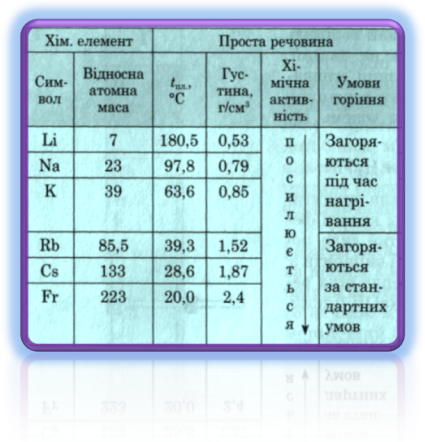 Фізичні властивості лужних металів.
Фізичні властивості лужних металів.
Отже, ви помітили,що лужні метали є легкі, м’які, але відрізняються температурою плавлення, кипіння, а також густиною. Активність лужних металів в групі зростає зверху вниз. Взаємодію лужних металів з різними речовинами вивчали хіміки-експериментатори.
Доповідь хіміків-експериментаторів.
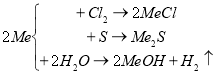 (На екрані слайд «Хімічні властивості лужних металів»).
(На екрані слайд «Хімічні властивості лужних металів»).
Розповідь вчителя.
Отже, лужні метали активно взаємодіють з водою. Хіміки зараз це продемонструють. Але перед цим необхідно пригадати правила техніки безпеки при роботі з хімічними речовинами.
(На екрані слайд «Правила техніки безпеки»).
Правила техніки безпеки
- Хімічні речовини не можна брати руками.
- Якщо розчин лугу потрапив на шкіру, його необхідно змити великою кількістю води і нейтралізувати розчином борної кислоти
Дослід.
У склянку наливаємо воду, додаємо кілька крапель індикатору фенолфталеїну, опускаємо шматочок Натрію. Спостерігаємо рух Натрію по воді, шипіння та зменшення його в розмірі аж до зникнення.
Бесіда.
- Як змінилось забарвлення фенолфталеїну? Чому?
- Чому Натрій плаває по воді?
- Чому шматок Натрію рухається?
- Який газ виділяється?
А зараз поринемо в чарівний світ казки. В деякому царстві росте диво-квітка. Її пелюстки мають різний колір. Хто цю квітку знайде, той зможе загадувати сім бажань. Оскільки, ми на уроці хімії, то я вам покажу цю хімічну квітку. Лужні метали та їх сполуки надають полум’ю характерного забарвлення.
Дослід.
В фарфорових чашках знаходяться солі літію, натрію, калію та цезію. Запалюємо дані солі та спостерігаємо гаму кольорів.
(На екрані диво-квітка «Забарвлення полум’я лужних металів»).
Забарвлення полум’я лужних металів
А зараз послухайте цікаву розповідь і подумайте, про який хімічний елемент йде мова, де він знаходиться в періодичній системі.
Роберт Вуд, знаменитий американський фізик і аматор усіляких витівок, направлявся з лабораторії додому на обід. Дорога йшла через негритянський квартал. Була зимова відлига і величезна калюжа розпростерлася по бруківці між тротуарами, на яких юрбилися негри, що вийшли погрітися на сонечку. Проходячи повз них Вуд голосно закашляв і плюнув у калюжу, непомітно кинувши в тім же напрямку шматок розміром з волоський горіх. Прогримів вибух, полетіли іскри, велике жовте полум’я піднялося над поверхнею води. Потім роздалися крики молитви і один голос голосніше від інших вигукнув: «Рятуйся, хто може, негри! Ця людина плюнула вогнем! На вигляд він молодий, але тільки нечиста сила вміє це робити!»
Розповідь вчителя. Ми з’ясували, що лужні метали досить активні, знаємо історію їхнього відкриття, а зараз кореспонденти розкажуть поширення та застосування.
Доповідь кореспондентів журналу «Хімія та біологія».
(На екрані слайд «Поширення лужних металів»).
Доповідь кореспондентів журналу «Хімія».(На екрані слайд «Застосування лужних металів»).
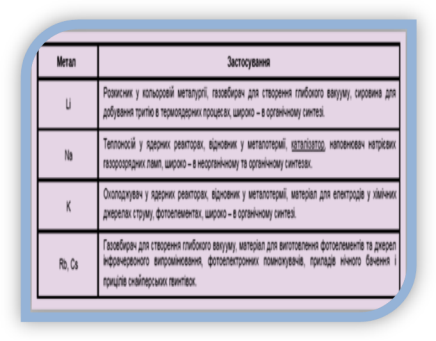 Застосування лужних металів
Застосування лужних металів
Розповідь вчителя.
Потрібно сказати, що лужні метали можуть частково стати і причиною екологічних катастроф. Аварія на ЧАЕС 26 квітня 1986р. спричинила вихід в атмосферу радіоактивної хмари, яка містила велику кількість радіоактивних продуктів, зокрема Цезію-137 та Цезію-134.
ІV Закріплення знань.
- Гра «Пін-понг».
- Чому метали І групи головної підгрупи називають лужними?
- Який метал отримав назву на честь країни світу?
- Які реакції характерні для лужних металів?
- Яку валентність вони проявляють?
- Робота в групах. Гра «Любить, не любить». Закінчити рівняння реакцій:
а) літій оксид + хлоридна кислота
б) Калій + хлор
в) Цезій + сірка
г) Рубідій + вода
д) калій гідроксид + сульфатна кислота
Найбільше проявляється любов до хімії у тої групи, що найшвидше і правильно виконає роботу. Хто справився з завданням піднімає символічне сердечко.
Перевірити дане завдання ви можете поглянувши на екран.
(На екрані слайд з правильними відповідями)
- Загадки.
Я метал, але який?
І сріблястий, і м’який.
Легко ріжуся ножем.
Нібито на торті крем.
Зберігаюся під гасом,
Як його не знайду часом,
Білим порошком вкриваюсь,
Помаленьку розсипаюсь.
Моїх йонів частку має
Сіль, що миттю вибухає.
Щоб вродили на городі,
Бульби і коренеплоди
добрива мої візьміть,
зважте норму, в ґрунт внесіть.
Калій
Я метал м’який, та знайте:
До води не підпускайте,
Бо у неї опущусь,
До поверхні піднімусь,
Пробіжуся і зникаю,
Газ доверху випускаю
А ще чую звідусіль:
Поклади у страву сіль!
Сіль кухонну, бо із нею
Завжди ми були ріднею.
Натрій
Його називають металом червоних вогнів. Якщо взяти цей метал у руки він починає плавитись, опустити у воду спалахує. Але він дуже потрібний людям. Наприклад, для виготовлення інтроскопів, якими просвітляють непрозорі тіла.
Цезій
- Ребуси (Слайд на екрані).
5. Тест-експрес
- Елемент Натрій був відкритий
а) Деві
б) Кавендішем
в) Шеєлє
г) Прістлі
2. Якого металу є в природі мізерні кількості
а) Літій
б) Натрій
в) Францій
г) Рубідій
3. Записати елементи в порядку зростання хімічної активності
а) Цезій
б) Натрій
в) Калій
г) Рубідій
4. Виявити зайвий метал
а) Кальцій
б) Рубідій
в) Берилій
г) Барій
5. Назва якого елемента в перекладі означає «зола рослин»
а) Купрум
б) Калій
в) Кальцій
г) Цезій
Правильні відповіді на екрані.
6. Головоломка.
- Відомий римський правитель Юлій … (ар міняємо на ій).
- Тепла пора року – О + сім‘я бджіл – р.
- Коштовний камінь червоного кольору – н + наказова форма дієслова діяти.
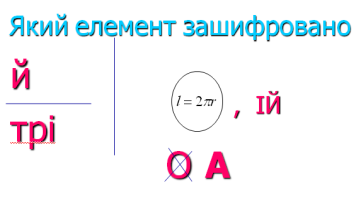
7. Відгадати елемент за підказками
- З його допомогою 2 січня 1959р. була створена і запущена в просторі всесвіту штучна комета.
- Цей елемент входить до складу багатьох мінералів.
- Даний елемент був відкритий 1807 р.
- Найважливішою сполукою, яку він утворюю є кам’яна або кухонна сіль.
На екрані слайд «Кристал натрій хлориду».
V Підсумок.
Рефлексія.
- Що нового ви дізнались на уроці?
- Чи все було зрозуміло?
- Що найбільше сподобалось?
Сьогодні ми переконалися, що хімія цікава наука, яка відкриває перед нами дивовижний світ хімічних елементів, дізналися про них багато цікавого і незвіданого. Цю істину підтверджують і слова Ломоносова, які були епіграфом даного уроку.
VI Домашнє завдання теж буде незвичайне і пов’язане із святом закоханих. Улюблений колір всіх закоханих червоний, тому хоча на вулиці зима, в нас розцвітають квіти, які ховають у своїх пелюстках домашнє завдання для кожної групи. (Квіти змочені лугом обприскуємо фенолфталеїном.)
Додатки
Доповідь істориків.
На початку ХІХ століття в Англії молодий 27-річний учений-хімік робив цікаві досліди. Подивитись на ті дива, як на цікаву виставу поспішала вся знать, бо в ті часи було модним відвідувати лабораторію Деві.
Учений розплавляв сіль, занурював у неї електроди, пропускав електричний струм і на очах у публіки відбувалось диво – замість солі утворювався сріблясто-білий метал. Таким чином одержали Натрій та Калій. Деві назвав Натрій содієм, а Калій – потасієм. Згодом Берцеліус запропонував Натрій, оскільки «натрон» арабською сода.
10 років потому у 1817 році шведським вченим Арвфедсоном був відкритий Літій. Цей учений аналізував новий мінерал – петаліт, який знайшли в залізорудній копальні. Молодий дослідник виділив у складі мінералу глинозем і кремнезем, але вони становили лише 96% маси мінералу, отже, 4% припадало на якийсь інший елемент. Ним виявився новий лужний метал, який утворював у воді розчинний сульфат. У вигляді сульфату він і виділив новий елемент з каменистого мінералу. Берцеліус назвав його Літієм (від грецького - камінь). Цим хотіли наголосити, що даний лужний метал знайдено в камені – мінералі.
Цезій і Рубідій відкрили 1860року німецькі вчені Бунзен і Кірхгоф – творці спектрального аналізу в мінералі лепідоліті. Згодом його було виявлено і в цілющих водах деяких джерел. Назва походить від латинського цезіус – блакитний колір спектральної лінії та рубідіус – червоний колір.
Існування Францію, під назвою екацезій передбачив ще Менделєєв. Йшли роки, елементи, передбачені великим вченим знаходили в природі. В пошуках екацезію вчені вирушали навіть до Мертвого моря, сподіваючись там знайти новий елемент. Але все стало реальністю лише після відкриття радіоактивності. У 1939 році Маргаритою Пере був відкритий Францій. Назву одержав на честь батьківщини винахідниці, тобто Франції.
Доповідь фізиків
Лужні метали – сріблясто-білого кольору, мають не щільно упаковану кубічну кристалічну ґратку, атоми в якій займають лише 68% об’єму, тому всі вони легкі. Літій взагалі найлегший метал. Він плаває не лише у воді, а й у гасі, тому його зберігають під шаром вазеліну. Якби можна було виготовити літак із літію, його могли б підняти двоє чоловік. Лужні метали легкі, м’які (ріжуться ножем), легкоплавкі, виявляють високу електричну провідність, мають металічний блиск на свіжому зрізі. Характеризуються незначною твердістю, малою густиною, низькими температурами кипіння і плавлення. З збільшенням відносної атомної маси лужних металів температура плавлення знижується, густина зростає, збільшується і хімічна активність, що пояснюється послабленням зв’язку між атомами.
Доповідь хіміків
Лужні метали досить активні. За стандартних умов взаємодіють з водою, киснем повітря та іншими неметалами. Завжди проявляють валентність І, на що вказує і номер групи в якій вони знаходяться. Різна хімічна активність відносно кисню та води зв’язана зі зміною відносної атомної маси: чим вона більша, тим більша активність лужного металу. Активність лужних металів зростає в ряді від літію до францію. Це пояснюється низьким значенням енергії, необхідної для відриву єдиного електрону. Взаємодіють лужні метали з неметалами – на свіжому повітрі окислюються, швидко тьмяніють, утворюючи пероксиди і оксиди як домішки. Лише Літій реагуючи з киснем утворює оксид, а інші – пероксиди.
4Li + O2 = 2Li2O
Рубідій та цезій самозапалюються на повітрі.
Взаємодіють лужні метали з галогенами. Наприклад, при взаємодії з хлором утворюються хлориди, в яких валентність хлору рівна І.
2К + Сl2 = 2КСl
Взаємодіють лужні метали з сіркою, утворюючи сульфіди.
2Na + S = Na2S
Також лужні метали активно взаємодіють з водою. Найбільш активний метал Францій.
Доповідь кореспондентів журналу «Хімія та біологія»
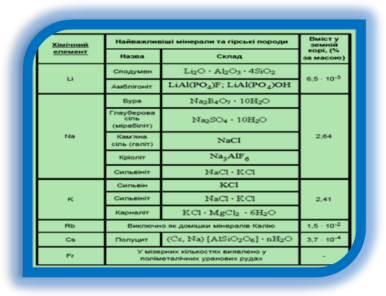
Натрій і Калій найбільш поширені представники лужних металів. Вміст у земній корі Натрію складає 2,64%, Калію – 2,6% у вигляді сполук. Найважливіша сполука натрію з хлором – це кам’яна або кухонна сіль. Найбільші поклади її забезпечені на Уралі та Донбасі, значні кількості натрій хлориду добувають з соляних озер. Товщина шару натрій хлориду в деяких родовищах досягає кілька сотень метрів.
Відомо близько 30 літієвих мінералів, але добувають його переважно із сподумену, а також з ропи соляних озер. Літій зустрічається в солях в складі рослинних організмів. Особливо багато його містять червоні і бурі водорості.
Рубідій та цезій належать до елементів з обмеженими запасами. Світовий об’єм добування цезію складає близько 9 тон в рік, а потреба більше 85 тон. По добуванні цезієвих руд лідирує Канада. В Росії родовища цезію знаходяться на Кольському півострові.
Францій в невеликих кількостях міститься в уранових рудах.
Доповідь кореспондентів журналу «Хімія»
Натрій і Калій широко застосовуються. Сполука Натрію, кухонна сіль, необхідна організму людини для забезпечення найважливіших фізіологічних процесів. У крові створює необхідні умови для існування червоних кров’яних тілець. За рік з їжею людина вживає приблизно 8 кг солі. Недарма в народі кажуть, щоб пізнати людину необхідно з нею пуд солі з’їсти. Виявляється, це не так багато, за вагою й часом за рік удвох і буде з’їдений пуд солі (≈16 кг).
Сполуки Натрію і Калію застосовують як добрива. Калій з іншими елементами відповідає за роботу м’язів, а головне – м’язу серця. Сполука Калію бертолетова сіль – обов’язкова складова святкового феєрверку.
Літій і його сполуки широко застосовують в силікатній промисловості для виготовлення спеціальних сортів скла і покриття порцеляни, в чорній і кольоровій металургії (для розкислювання, підвищення пластичності і міцності сплавів), для отримання пластичних мастил. Сполуки літію використовуються в текстильній промисловості (вибілювання тканин), харчовій (консервація) і фармацевтичній (виготовлення косметики). Солі літію використовуються в медицині як антидепресанти. У живих організмах літій міститься головним чином в печінці і легенях.
Рубідій і Цезій застосовують в електроніці й автоматиці, в атомних реакторах і космічних кораблях, для виготовлення інтроскопів, якими просвітляють непрозорі тіла.
Про Францій можна говорити як про елемент майбутнього. Цікаві перспективи його використання в біологічних дослідженнях, зокрема для виявлення раку на ранніх стадіях. Він допомагає розпізнати цю страшну хворобу на початку.
1


про публікацію авторської розробки
Додати розробку
