Урок "Поширеність в природі та використання оксидів, кислот, основ і солей. Вплив на довкілля."
Тема : Поширеність в природі та використання оксидів, кислот, основ і солей. Вплив на довкілля.
Мета: визначити поширеність в природі та використання неорганічних речовин людиною, формувати уявлення про екологічні проблеми на початку ХХІ століття, пов’язані з видобутком і використанням основних класів неорганічних речовин; установити суть, причини, наслідки і шляхи їх вирішення;на основі здобутих знань формувати стійке ціннісне ставлення до природи, здоров’я, усвідомлення необхідності хімічних, біологічних, математичних знань для розв’язування екологічних проблем, формувати цілісні знання про важливі екологічні проблеми на основі предметів природничого циклу та математики.
Очікувані результати:
знаннєвий компонент: учні мають чіткі, цілісні знання про такі екологічні проблеми, як парниковий ефект, кислотні дощі та озонові діри;
діяльнісний компонент: пояснюють суть причини виникнення, наслідки цих глобальних екологічних проблем, опираючись на інтегровані знання та вміння з предметів природничого циклу та математики; ціннісний компонент: висловлюють судження про значення хімічного експерименту як способу набуття нових знань, учні критично оцінюють власні знання, уміння та навички;оцінюють наслідки своєї діяльності на стан довкілля.
Тип уроку: урок засвоєння нових знань.
Форма організації навчального процесу: групова.
Методи навчання: проблемний, частково-пошуковий, дослідницький.
Хід уроку
І. Привітання. Організація класу.
ІІ. Визначення теми і мети уроку.
- Дітям задаються питання для визначення 1 чистини теми (З чого складається світ навколо нас? З чого складаються тіла? З яких речовин?..). Записуємо першу частині теми «Поширеність в природі…
- Для підтримання життєдіяльності людина вилучає з природного середовища або синтезує деякі речовини (їжа, пакувальні матеріали, одяг, машини, будівлі тощо. Записуємо другу частину теми «…та використання…»
- Які неорганічні речовини людина у побуті, сільському господарстві а виробництві? Записуємо третю частину теми «…оксидів, кислот, основ і солей.».
- Чи завжди вони корисні і безпечні для людей і природи? Навести декілька прикладів. Записуємо четверту частину теми «…Вплив на довкілля.»
ІІІ. Робота на уроці потребує ваших знань з інших предметів, тому девізом уроку обираємо слова німецького філософа і публіциста Г.К. Ліхтенберга: «Хто не розуміє нічого, крім хімії, той і її розуміє недостатньо» (вивішується на дошку)
IV. Роз’яснення роботи на уроці.
Клас ділиться на 4 групи: ОКСИДИ, КИСЛОТИ, ОСНОВИ, СОЛІ. У кожній групі повинно бути по 1-2 людини з наступними посадами: ЛІКАР, ЕКОЛОГ, ГЕОЛОГ, ХІМІК-ТЕХНОЛОГ. Кожна група працює над своїм проектом (згідно назви) і оформлює його на великому кубі.
V. Виконання проектів.
1-й етап: всі групи розглядають питання «Поширення в природі неорганічних речовин», оформлюють одну грань куба, готують виступи, використовуючи готові матеріали на столах (самостійна робота, звучить музика); виступають ГЕОЛОГИ з різних груп з демонстрацією оформленого і порівнянням поширеності основних класів неорганічних сполук в природі.


2-й етап: розглядається питання використання людиною речовин за попереднім планом; виступають ХІМІКИ-ТЕХНОЛОГИ.


3-й етап: з’ясовуємо питання впливу деяких речовин на здоров’я людини; виступають ЛІКАРІ.


4-й етап: працюють над питанням «Вплив на довкілля основних класів неорганічних речовин»; виступ ЕКОЛОГІВ.


VI. Підведенні підсумків роботи над проектами.
VII. Обговорення цитат великих людей, в яких йдеться про хімічні речовини:
"Правду кажуть, що людина повинна з'їсти пуд солі зі своїм другом, щоб як слід знати його." ( Мігель де Сервантес) (1 пуд = 16,4 кг, норма солі = 10 г на добу; 1 пуд з’їмо на двох 16,4: 0,01:2 = 820 днів; 820:365 днів = 2,25 років потрібно, щоб знати людину)
Лінь, як іржа, роз'їдає швидше, ніж праця зношує. (Еміль Мейерсон , французький філософ)
Гнів є кислотою, яка може нанести більше шкоди посудині, в якій вона зберігається, ніж тому, на кого вона виливається. (Марк Твен)
Рослина - посередник між небом і землею. Вона - істинний Прометей, який викрав вогонь з неба. (Климент Аркадійович Тімірязєв)
Людина - істота розумна, але після того, як мій кіт відмовився їсти варену ковбасу, я задумався ... (Ігор Субботін)
VIIІ. Кожна група розповідає вірш (уривок) на екологічну тему
ІХ. Підсумки уроку.
Чи цікаво було працювати?
Чи важко було?
Що ви вже знали і що дізнались нового?
Що вважаєте найважливішим?...
Х. Домашнє завдання: написати есе «Моє довкілля»
- від імені учня
- від імені власника ГЗКа
- від імені власника завода з виробництва хімічних добрив
- від імені директора ТЕС
- від імені власника металургійного заводу.
Матеріали до уроку
КИСЛОТИ
Геологи
Поширення кислот у природі.
Вам відомо, що назва «кислоти» пов’язана з тим, що ці речовини мають характерний кислий смак. У природі вони поширені в організмах рослин, тварин і людини, входять до складу грунтів, утворюють термальні кислотні озера, випадають на землю у вигляді кислотних дощів, є компонентами нашої їжі.
Пригадайте і назвіть продукти, яким властивий кислий смак.
Усі нестиглі фрукти, зокрема яблука, сливи, вишні, черешні, алича та in., як правило, дуже кислі. Кислого смаку їм падають органічні кислоти, які містяться в соках цих фруктів. Так, кислий смак лимонам надає лимонна кислота, щавлю щавлева, яблукам — яблучна.
Деякі продукти, скисаючи, теж стають кислими завдяки утворенню в них кислот. Зокрема, у кислому молоці під дією молочнокислих бактерій утворюється молочна кислота. Вона ж присутня в усіх молочнокислих продуктах. У кропиві, ягодах смородини, листках і корі верби багато саліцилової кислоти. Кислоти наявні й у деяких представників тваринного світу. Хто з вас не відчував укус мурашки? Під час укусу для власного захисту вона виробляє мурашину кислоту.
Усе, що говорилося про поширення цих речовин, стосується органічних кислот. Однак природа наділила живі організми й неорганічними кислотами, як у рослинному, так і в тваринному світі. Наприклад, у ядрах кісточок абрикосів, слив, вишень у невеликій кількості міститься дуже отруйна ціанідна кислота.
Деякі жуки для захисту виділяють сульфатну кислоту.
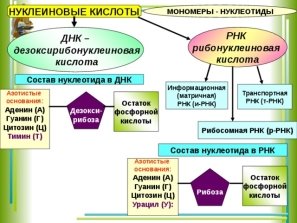
Залишки ортофосфатної кислоти входять до складу АТФ, ДНК, РНК
Хлоридна кислота виробляється організмом людини й міститься у шлунковому соці. З її участю відбувається процес травлення. Як антисептик, вона знешкоджує у шлунку бактерії, які потрапляють туди з їжею.
У багатьох природних джерелах Трусекавця та Східниці, Немирова мінеральні води насичені сульфідною кислотою, завдяки чому вони мають характерний запах. В інших джерелах Труекавця, Сваляви, Миргорода у воді розчинена карбонатна кислота, що, розпадаючись, виділяє бульбашки вуглекислого газу.
Кавах Іджен, озеро на острові Ява, Індонезія - водойма є гігантською ванною соляної кислоти. Озеро визнано самим кислотним в світі, а температура води досягає 60 градусів за Цельсієм на поверхні і більше 200 - в глибині. При відвідуванні озера обов'язково надягати маску, яка захищає від кислотних парів.
Хіміки-технологи
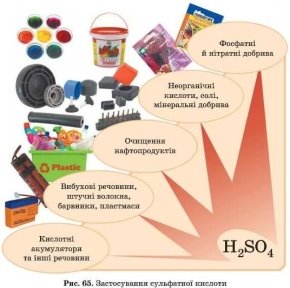
Застосування кислот.
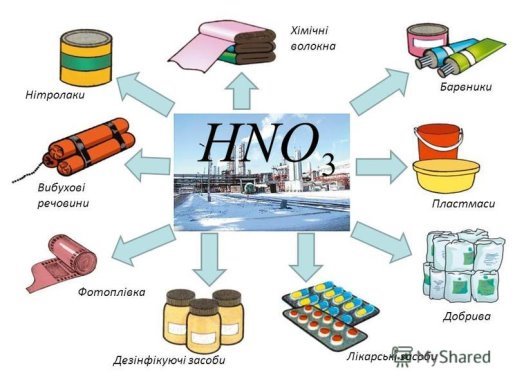
Кислоти є важливими речовинами, що відіграють велику роль у житті й життєдіяльності людини. Як уже зазначалося, вони сприяють процесу травлення, є дієвими антисептиками.
Однак най ширше застосування ці речовини отримали в хімічній промисловості. За участю кислот добувають солі, зокрема:
хлориди, сульфати, нітрати, сульфіди, ортофосфати й ін. Кислоти використовують у фармацевтичній, металургійній, туковій (виробництво мінеральних добрив) промисловостях, для добування вибухових речовин, барвників, інших кислот тощо.
Лікарі
Вплив на здоров’я людини
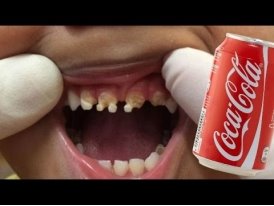
Чим загрожує підвищена кислотність? Неправильне харчування (а саме надмірне споживання кислої їжі, штучних напоїв, що містять ортофосфатну і інші кислоти ) і недотримання водного балансу призводить до так званого закислення організму, при якому погіршується транспортування кисню до органів, а також тканин.
Але і це ще не все: при підвищеній кислотності погано засвоюються мінерали, тоді як деякі з них (наприклад, кальцій, калій, натрій і магній) і зовсім виводяться з організму. В результаті багаторазово зростає ризик розвитку серцево-судинних хвороб, знижується імунітет.
Під дією кислот з гірських порід і мінералів вивільняється алюміній, а також ртуть і свинець, що потім потрапляють у поверхневі і ґрунтові води
Алюміній здатний викликати хворобу Альцгеймера - різновид передчасного старіння. Важкі метали, що потрапляють у природні води, негативно впливають на нирки, печінку, центральну нервову систему, викликаючи різні онкологічні захворювання. Генетичні наслідки отруєння важкими металами можуть проявитися через 20 років і більш не тільки в тих, хто вживає брудну воду, але й у їхніх нащадків.
Забруднення повітря кислотою утворюючими викидами робить різноманітний шкідливий вплив і на організм людини. Вдихання вологого повітря, що містить діоксид сірки, особливо небезпечно для людей похилого віку, що страждають серцево-судинними і легеневими захворюваннями, у важких випадках може виникнути набряк легень. Шкідливо це і для здорових людей, оскільки SO2 і сульфатні частки мають канцерогенну дію. Установлено тісний взаємозв'язок між підвищенням смертності від бронхітів і ростом концентрації діоксиду сірки в повітрі. Під час небезпечного лондонського туману 1952 р. більш 4000 смертей було віднесено за рахунок підвищеного вмісту у вологому повітрі діоксиду сірки і сульфатних часток. Численні дослідження показали збільшення числа захворювань дихальних шляхів у районах, повітря яких забруднений діоксидом азоту NO2. Потрапляючи в дихальні шляхи, він взаємодіє з гемоглобіном крові, утрудняючи перенос кисню до органів і тканин, викликає респіраторні, астматичні і серцеві захворювання. У лютому 1972 р. у Японії з цієї причини занедужало більш 70 000 чоловік, для багатьох з них захворювання мало летальний результат
Екологи
Вплив на довкілля
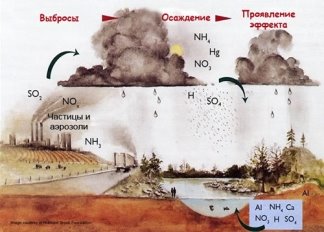
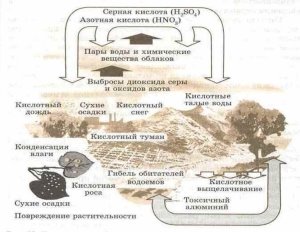
У районах, де розвинуто виробництво та переробка сірки, в атмосфері накопичуються сульфур(ІУ) та сульфур(УІ) оксиди, які, сполучаючись із дощовою водою, утворюють кислоти. Аналогічний процес спостерігається під час виробництва нітратної кислоти.
У водяних екосистемах кислотні опади викликають загибель риб та інших водяних мешканців. Підкислення води рік і озер серйозно впливає і на тварин суходолу, тому що багато звірів і птахів входять до складу харчових ланцюгів, що починаються у водяних екосистемах. Разом із загибеллю озер стає очевидною і деградація лісів. Кислоти порушують захисний восковий покрив листя, роблячи рослини уразливішими для комах, грибів і інших патогенних мікроорганізмів. Під час посухичерез ушкоджені листи випаровується більше вологи. Вилуджування біогенів із ґрунту і вивільнення токсичних елементів сприяє уповільненню росту і загибелі дерев. Можна припустити, що відбувається і з дикими видами тварин, коли гинуть ліси. Якщо руйнується лісова екосистема, починається ерозія ґрунту, засмічення водоймищ, повінь і погіршення запасів води стають катастрофічними. Підкислення ґрунту азотнокислими дощами стимулює розвиток лісових шкідників. У результаті закислення в ґрунті відбувається розчинення живильних речовин, життєво необхідних рослинам; ці речовини виносяться дощами в ґрунтові води. Одночасно вилуджуються з ґрунту і важкі метали, що потім засвоюються рослинами, викликаючи в них серйозні ушкодження. Використовуючи такі рослини в їжу, людина також одержує разом з ними підвищену дозу важких металів. Коли деградує ґрунтова фауна, знижуються врожаї, погіршується якість сільськогосподарської продукції, а це, як ми знаємо, спричиняє погіршення здоров'я населення..
Кислотні дощі роз'їдають метали, фарби, синтетичні з'єднання, руйнують архітектурні пам'ятки. Багато скульптур і будинкиів у Римі, Венеції й інших містах, пам'ятники зодчества, такі, як Парфенон у Афінах, Кельнський собор та інші, за кілька останніх десятиліть одержали значно більші ушкодження, ніж за весь попередій час. Під загрозою повного руйнування в результаті дії кислотних опадів знаходяться більш 50 тис. скульптур скельного «Міста Будд» під Юньанем у Китаї, побудованого 15 століть тому. Найхарактерніші кислотні дощі для індустріальних країн з високорозвиненою енергетикою. Найбільшу втрату вони нанесли лісам Центральної Європи, зокрема 35 % лісів Німеччини (на площі більш 2,5 млн га) ушкоджені ними Збиток від кислотних дощів для європейських лісів оцінюється в 118 млн м3 деревини в рік (з них близько 35 млн м3 на європейській території Росії) У меншому ступені від кислотних дощів страждають сільськогосподарські рослини, оскільки підкислення ґрунтів тут можна контролювати агрохімікатами. Для боротьби з кислотними дощами необхідно направити зусилля на скорочення викидів кислотоутворюючих речовин вугільними електростанціями.
Більшість заклопотаних власними проблемами людей і недалекоглядних державних діячів залишається байдужими до проблеми кислотних дощів.

Озеро з хлоридною кислотою


HCN – ціанідна кислота в кісточках
У шлунку – хлорид на кислота
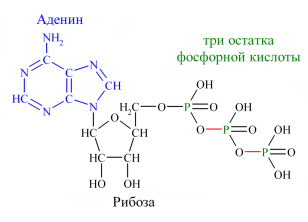
Залишки ортрфосфатної кислоти в НК



ОКСИДИ
Геологи
Оксиди в природі
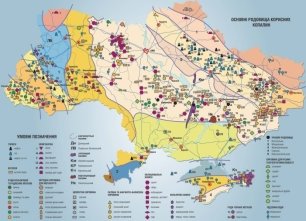
Оксиди містяться в кожній з трьох оболонок нашої планети - в атмосфері, гідросфері, літосфері.
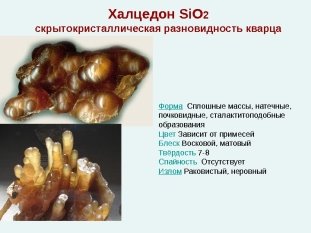
Найпоширенішим оксидом в атмосфері і гідросфері є вода H2O, а в літосфері - оксид кремнію (IV) SiO2, зустрічається у вигляді красивих кристалів кварцуі кварцового піску. Його різновидами є гірський кришталь, агат, аметист, халцедон,
Найпоширеніші Si, Fe, Mn, Al, в меншій мірі Cu, U.
Велике практичне значення О.п. визначається тим, що до них належать такі найважливіші рудні мінерали, як магнетит, гематит, піролюзит, каситерит, ільменіт, рутил, лопарит, пірохлор, мікроліт, танталіт, колумбіт, вольфраміт, хроміт, баделеїт і ін., а також кварц, корунд і його дорогоцінні різновиди (рубін, сапфір), ювелірні різновиди хризоберилу (олександрит) і т.і.
У наш час у Кривбасі добуваються три основні промислові типи залізних руд: багаті руди, які безпосередньо використовуються в металургії, магнетитові і окислені залізисті кварцити, які потребують збагачення. Багаті руди: вміст заліза в них більш 46%, Видобувають їх переважно підземним способом.
Магнетитові кварцити (понад 10% заліза), добувають головним чином кар'єрним способом, а в останні роки і шахтним; окислені (30 - 46% заліза) - лише відкритим способом.
Крім того, на Криворіжжі є і унікальні в своєму роді камені, представлені променистим кварцом - різноманітні природні "очі", повний перелік яких - "котячі", "зміїні", "соколині", "тигрові" - можна знайти в криворізьких гірських породах. Особливе місце в переліку порід, які після обробки стають красенями, займають криворізькі яшми, які і зараз можливо добувати в кар'єрі Кочубей, розташованому біля села Ганнівка на північ від Південного ГЗК.
У Криворізькому басейні є поклади будівельних пісків, суглинків та інших.
Хіміки-технологи
Застосування оксидів
Відомо близько 300 оксидів.
промисловості та побуті має найважливіший природний оксид вода H2O. Вода використовується в усіх галузях господарської діяльності людини. Практично неможливо назвати жодний виробничий процес, у якому б не застовувалась вода.
З залізних руд, що містять оксиди заліза, отримують залізо.
Пісок, що складається переважно складається з SiO2, використовують при виробництві скла.
Деякі оксиди є основою для фарб: ZnO - білої, Fe2O3 - коричневої, Cr2O3 - зеленої.
А природні і штучні кристали оксидів алюмінію, забарвлені домішками, використовують для виготовлення ювелірних прикрас.
Оксиди активно використовуються у виробництві будівельних матеріалів, скла, фарфору, фаянсу, магнітних матеріалів. Оксиди металів (Феруму, Ніколу, Алюмінію, Стануму та інших є сировиною у виробництві металів. Оксиди неметалів (Сульфуру, Фосфору, Нітрогену застосовуються у виробництві відповідних кислот. Деякі оксиди можуть бути використані як вогнеупори: силіцій (IV) оксид SiO2, магній оксид MgO, алюміній оксид Al2O3, як каталізатори: ванадій (V) оксид V2O5, алюміній оксид Al2O3, як адсорбенти: силікагель SiO2. Із руд, які містять оксиди Феруму Fe2O3 та Fe3O4, добувають чавун і сталь
Лікарі
Вплив на здоров’я
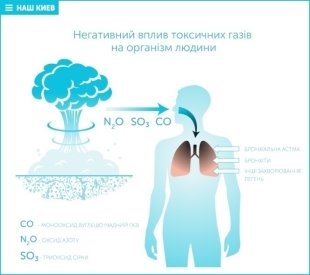
Оксиди входять до складу вихлопних газів
СО - безбарвний газ, що не має запаху. Впливає на нервову і серцевосудинну систему, викликає задуху.. У разі перевищення норм вмісту у крові 15-6% СО – гемоглобіну виникає стан отруєння.
(СО2) - або вуглекислий газ, - безбарвний газ з кислуватим запахом і смаком, продукт повного окислення вуглецю. Є одним з парникових газів.
Оксиди азоту. NO, N2O3, NO5, N2O4. В атмосферу викидається в основному діоксид азоту NO2 – безбарвний отруйний газ, що не має запаху, дратівливо діє на органи дихання. Особливо небезпечні оксиди азоту в містах, де вони взаємодіють з вуглецями вихлопних газів, де утворюють фотохімічний туман - смог. Отруєний оксидами азоту повітря починає діяти з легкого кашлю. При підвищенні концентрації NO, виникає сильний кашель, блювота, іноді головна біль. При контакті з вологою поверхнею слизистої оболонки оксиди азоту утворюють кислоти HNO3 і HNO2, які приводять до набряку легенів.
SO2 - безбарвний газ з гострим запахом, вже в малих концентраціях (20- 30 мг/м3) створює неприємний смак в роті, дратує слизисті оболонки очей і дихальних шляхів.
Сполуки свинцю. У організм через органи дихання поступає приблизно 50% сполук свинцю. Під дією свинцю порушується синтез гемоглобіну, виникає захворювання дихальних шляхів, сечостатевих органів, нервової системи. Особливо небезпечні з'єднання свинцю для дітей дошкільного віку. У великих містах вміст свинцю в атмосфері досягає 5-38 мг/м3, що перевищує природний фон в 10 000 разів.
Тривалий контакт із середовищем, отруєним вихлопними газами автомобілів, викликає загальне ослаблення організму — імунодефіцит. Крім того, безпосередньо токсичні і шкідливі гази можуть стати причиною різних захворювань. Наприклад, дихальної недостатності, гаймориту, ларинготрахеїту, бронхіту, бронхопневмонії, раку легень. Крім того, вихлопні гази викликають атеросклероз судин головного мозку. Опосередковано через легеневу патологію можуть виникнути і різні порушення серцево-судинної системи.
Екологи
Коли з атмосферним киснем і водяною парою з'єднуються оксиди сірки і азоту виникають кислотні дощі. Ці оксиди викидаються в навколишнє середовище металургійними підприємствами, електростанціями, автомобільним транспортом. Отримані таким чином кислоти мають вигляд дощу і розносяться вітром.
Таким чином в повітрі з'являються домішки кислот: сульфатної, сульфітної, нітратної і нітритної. І ці домішки з опадами потрапляють на землю. Кислотні дощі негативно позначаються на зростанні рослин, здоров'я тварин і людей.
У 1952 році непрозорий туман охопив вулиці Лондона, в результаті чого загинуло 4000 жителів. Частинки смогу дратували дихальні шляхи, а в легенях з'являлася слиз. Багато людей отримали серцеві напади з попереднім важким кашлем. За оцінками вчених той туман був більш кислим, ніж лимонний сік. Потім урядом було заборонено спалювати в місті паливо, утворює велику кількість диму. Це було зроблено, щоб уникнути утворення сірчаної та азотної кислот.
Врожайність багатьох культур зменшується на 3-8%, тому що листя пошкоджуються кислотами.
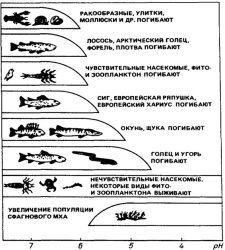
Змінюється склад води в озерах і ставках. В результаті гине риба і багато видів комах. Зникають птахи і тварини, які ними харчуються. У равликів стоншується карбонатна черепашка, яка захищає їх. В результаті вони гинуть. Також руйнуються черепашки мешканців водойм. Це негативно позначається на екосистемах.
Кислотні дощі закислюють грунти. Більшості рослин це не до вподоби. Існує зовсім небагато рослин, здатних рости на кислих грунтах без шкоди для себе. Така рослина - хвощ польовий – бур’ян.
Крім того кислотні дощі збільшують корозію металів, руйнують мармур і вапняк.
Одним з основних і найбільш великомасштабних джерел забруднення атмосфери є ТЕС і ТЕЦ.
Після того, як було визначено шкоду подібних дощів, в розвинених країнах стали встановлювати уловлювачі, що не пропускають кислотні оксиди в повітря.
Що робити?
- Переходити на електрокари
- Використовувати альтернативні джерела енергії
- Встановлювати фільтри на виробництвах

















ОСНОВИ
Геолог
ПОШИРЕННЯ ОСНОВ У ПРИРОДІ
У природі луги майже не трапляються: по-перше, вони розчинні й будуть вимиватися водою, а по-друге, вони дуже активні й легко беруть участь у хімічних реакціях.
Озеро Натрон, Танзанія. Все живе, що торкнеться озера, застигає як статуя. Правда, звучить як мотив чарівної казки? Тим не менш, це факт: озеро оточують «статуї» тварин, що опинилися занадто близько . І тут немає ніякого чаклунства.
Натрон - солоне і лужне озеро, в деяких місцях рівень pH коливається від 9 до 10,5, а температура може досягати 50 градусів за Цельсієм. Озеро вкрите кіркою солі, яка може фарбуватися в червоний або рожевий колір. Через температуру і лужность багато тварин, потрапляючи в воду, гинуть, а їх останки покриваються мінералами, по суті перетворюючись в кам'яні скульптури. Зате тут мешкають малі фламінго, а «вогняні» води озера захищають їх від підступних хижаків..
Нерозчинні основи можуть входити до складу деяких мінералів у вигляді основних солей. Іржа, яка утворюється на сплавах заліза, теж частково складається з гідроксидів Феруму
Кров і вміст клітин має слабо лужну реакцію.
Хімік технолог
ЗАСТОСУВАННЯ ОСНОВ
Луги застосовують: В якості електролітів. Для виробництва добрив. У медицині, хімічних, косметичних виробництвах. У рибництві для стерилізації ставків.
Їдкий натр Найпопулярніша і затребувана в світі луга. Застосовується для омилення жирів у виробництві косметичних і миючих засобів, для виготовлення масел в процесі нафтопереробки, як каталізатор і реактиву в хімічних реакціях; в харчопромі.
їдке калі Застосовується для виробництва мила, калійних добрив, електролітів для батарейок і акумуляторів, синтетичного каучуку. Також - в якості харчової добавки; для професійного очищення виробів з нержавіючої сталі.
гідроксид алюмінію Затребуваний в медицині як відмінний адсорбент, антацид, обволікаючий засіб; інгредієнт вакцин в фармацевтиці. Крім цього, речовина застосовується в очисних спорудах і в процесах отримання чистого алюмінію.
гідроокис кальцію Популярна луг з дуже широким спектром застосування, яку в побуті знають під назвою «гашене вапно». Використовується для дезінфекції, пом'якшення води, у виробництві добрив, їдкого натру, «хлорки», будівельних матеріалів. Застосовується для захисту дерев і дерев'яних споруд від шкідників і вогню; в харчопромі як харчова добавка і реактив при виробництві цукру.
гідроокис літію Затребуване з'єднання в хімпромі як сировину; в скляній, керамічній, Фіксаналирадіотехніческой індустрії; для виробництва мастильних матеріалів, електролітів; для поглинання шкідливих газів.
гідроокис барію Застосовується в хімпромі як каталізатор, а також в харчопромі для очищення жирів, цукру.
купрум гідроксид (Cu(OH)2) використовують для надання забарвлення склу й емалям.
Цинк гідроксид (Zn(OH)2) — компонент багатьох фарб і мазей. Для одержання каталізаторів і пігментів використовують кобальт гідроксид (Co(OH)2).
Для виготовлення зубних паст, як адсорбуючий засіб у медицині застосовують алюміній гідроксид (Al(OH)3).
Mg(OH)2 застосовують як адсорбент у фільтрах для води. Mg(OH)2 тa Al(OH)3 застосовують як наповнювачі для пластмас для надання їм негорючості.
З допомогою берилій гідроксиду (Be(OH)2) одержують вогнетривку кераміку й компоненти стекол, які пропускають ультрафіолетові промені.
Лікар
Опіки лугами
Саме луги, а не кислоти, викликають більш сильні опіки, так як їх складніше змити з шкіри і вони проникають глибоко в тканини.
Перша допомога при хімічних опіках полягає в багатому промиванні обпаленої місця струменем води. При опіку лугом обробіть уражене місце 1% -м розчином оцтової, лимонної, борної кислоти. Концентровані, особливо гарячі, розчини лугів викликають сильні опіки. Спочатку. шкіра стає слизькою і гладкою, а після більш тривалого впливу лугів утворюються дуже глибокі рани, що повільно загоюються. Подібним же чином діють на шкіру тверді луги навіть в разі зіткнення з нею протягом всього декількох хвилин.
При опіках лугами відбуваються омилення жирового шару шкіри, зневоднення тканин і розчинення білкових речовин. Характерною особливістю лугів є те, що вони всі без винятку здійснюють подразнюючу дію на слизові оболонки і тканини.
Для захисту від опіків лугом або кислотою всі роботи, пов'язані з ними, необхідно виробляти в спеціальному одязі, захисних окулярах і кислотостійких рукавицях.
Еколог
Екологічні проблеми
Хоч гідроксид алюмінію і не токсичний для людини, він дуже токсичні для життя риб і водного середовища. Інші гідроксиди, як відомо, не шкідливі для рослин і деякі з них використовуються для зміни кислотності грунту в садах і сільському господарстві, для стимулювання росту рослин. Основна проблема у використанні і утилізації сполук алюмінію, щоб уникнути їх стоку в річки і озера, де вони можуть змінити екосистеми. Вони використовуються в штучних ставках, щоб перешкоджати зростанню водоростей.


Лужне озеро Іржа



Застосування алюміній і магній гідроксидів

Застосування кальцій гідроксиду


Застосування літій гідроксиду

СОЛІ
Геологи
Солі в природі
Солі містяться в клітинному соку, крові, сльозах, поті, входять до складу різних тканин: кісткової, нервової, м'язової. В тілі дорослої людини міститься більше 200 г хлориду натрію, з яких 45 г розчинено в крові. Недостача солі в їжі згубно впливає на здоров’я. Вважають, що масова загибель наполеонівських солдат при їх відступі від Москви була обумовлена нехваткою солі в їжі. У древніх народів нерідко були війни із-за соляних джерел. У римлян жодне жертвоприношення не обходилося без солі. А римські легіонери часів Цезаря частину платні отримували сіллю
Масова частка солей в організмі людини становить 5,5 %. Живі організми потребують постійного надходження солей. Тваринні організми одержують їх із питною водою та харчовими продуктами, а в рослини солі надходять з ґрунту разом з водою.
Галіт (гр. ἅλς – сіль) – це мінерал зі складом NaCl, дуже розповсюджений у природі. Єдиний твердий мінерал, який людина вживає у їжу. Його запаси є у США, Канаді, Німеччині, Росії , Італії. На Україні галіт трапляється в Закарпатті, Криму (озеро Сасик, затока Сиваш), Донецькій і Одеській областях і у деяких інших регіонах. Поблизу міста Артемівська (Донецька область) є маленьке містечко Соледар, в якому розташована одна з найкрупніших у Європі копалень солі.
![]() – чилійська селітра сьогодні відійшла в історію, а 100 років тому про неї говорили багато. На величезних просторах республіки Чилі простягається похмура пустеля Атакама. Вона тягнеться на сотню кілометрів. На перший погляд – це найзвичайнісінька пустеля, але в ній є одна особливість: під тонким шаром піску залягають потужні поклади нітрату натрію або натрової селітри. Її хотіли використати для виробництва пороху. Терміново спорядили експедицію, щоб доставити в Європу заокеанський продукт, але весь вантаж довелось кинути в море: для виробництва пороху необхідна була калієва селітра, але історія з чилійською селітрою не закінчилась. Виявилось. Що вона є цінним азотним добривом.
– чилійська селітра сьогодні відійшла в історію, а 100 років тому про неї говорили багато. На величезних просторах республіки Чилі простягається похмура пустеля Атакама. Вона тягнеться на сотню кілометрів. На перший погляд – це найзвичайнісінька пустеля, але в ній є одна особливість: під тонким шаром піску залягають потужні поклади нітрату натрію або натрової селітри. Її хотіли використати для виробництва пороху. Терміново спорядили експедицію, щоб доставити в Європу заокеанський продукт, але весь вантаж довелось кинути в море: для виробництва пороху необхідна була калієва селітра, але історія з чилійською селітрою не закінчилась. Виявилось. Що вона є цінним азотним добривом.
![]() – одна з найпоширеніших сполук на Землі. Мінерали на основі кальцій карбонату вкривають близько 400 млн.
– одна з найпоширеніших сполук на Землі. Мінерали на основі кальцій карбонату вкривають близько 400 млн. ![]() земної поверхні. Крейда, мармур, вапняк, черепашник – усе це кальцій карбонат. (сталактити та сталагміти також)
земної поверхні. Крейда, мармур, вапняк, черепашник – усе це кальцій карбонат. (сталактити та сталагміти також)
На території Кривого Рогу знаходяться родовище мармуру і велике родовище доломітів (рудник Фрунзе) з промисловими запасами понад 112 млн. т (майже 40% загальних балансових запасів України).
У Криворізькому басейні є поклади покрівельних сланців (Шмаково), сурику, охри талькових сланців.
Хіміки-технологи
Застосування солей
Солі повсюдно використовуються як у виробництві, так і в повсякденному житті.
Солі хлоридної кислоти. Хлорид натрію (кухонну сіль) виділяють з озерної та морської води, а також добувають в соляних шахтах. Кухонну сіль використовують в їжу. У промисловості хлорид натрію служить сировиною для отримання хлору, гідроксиду натрію і соди.
Розчин питної соди – складова частина заряду пінного вогнегасника. При використанні вогнегасника сода взаємодіє з сірчаною кислотою. Виділяється велика кількість ![]() , який і утворює велику піну.
, який і утворює велику піну.
Розчин питної соди використовують у медицині для зниження кислотності шлункового соку, для полоскання горла при ангіні.
Хлорид калію використовують в сільському господарстві як калійне добриво.
Солі сульфатної кислоти. У будівництві і в медицині широко використовують гіпс, одержуваний при випаленні гірської породи (дигідрат сульфату кальцію). Будучи змішаний з водою, він швидко застигає, утворюючи дигідрат сульфату кальцію, тобто гіпс.
Декагідрат сульфату натрію використовують як сировину для отримання соди.
Нітрати найбільше використовують як добрива в сільському господарстві. Найважливішим із них є нітрат натрію, нітрат калію, нітрат кальцію і нітрат амонію. Зазвичай ці солі називають селітрами.
З ортофосфатов найважливішим є ортофосфат кальцію. Ця сіль є основною складовою частиною мінералів - фосфоритів і апатитів. Фосфорити і апатити використовуються в якості сировини у виробництві фосфорних добрив, наприклад, суперфосфату і преципитата.
Карбонат натрію (соду) застосовують у виробництві скла і при варінні мила.
Карбонат кальцію Крейда – це не тільки школярська крейда та зубний порошок. Її використовують у паперовій та гумовій промисловості як наповнювач.
Мармур використовують для скульптурних робіт, а з менш цінного виготовляють електротехнічні щити.
Вапняками мостять дороги, за допомогою них зменшується кислотність грунту.
KCN – дуже отруйна сіль, хоч вигляд її зовсім невинний. Ціанистий калій необхідний для добування золота і срібла з руд, для добування багатьох органічних речовин. А ще цю сіль додають у сталь – це додає її поверхні великої міцності.
Лікарі
Застосування і вплив на організм людини
Сульфат натрію Na2SO4 ( "глауберової сіль", яка до цих пір використовується як проносний засіб). Є гірка, або "англійська", сіль - сульфат магнію MgSO4. Її теж використовують в медичних цілях як проносне і заспокійливий засіб.
Є серед солей і солодкі. Це, наприклад, хлорид берилію BeCl2. Цікаво, що вчені, що вперше отримали сполуки берилію, навіть пропонували дати цьому елементу ім'я "гліциній" за смак солей. А ще одна солодка сіль ацетат свинцю Pb (CH3COO) 2 так і називається - "свинцевий цукор", або "цукор-сатурн" (сатурн - алхімічні назва свинцю, на ім'я "відповідної" йому планети). Ацетат свинцю входить до складу "свинцевої примочки" - кошти від ударів.
Щоб в наш цивілізований час пробувати на смак солі свинцю, а тим більше берилію, треба бути абсолютно безрозсудним людиною: ці речовини отруйні. Ще одна надзвичайно отруйна сіль дуже часто потрапляє в головні "герої" детективних оповідань і шпигунських історій - це ціанід калію KCN. Старовинні книги стверджують, що ця сіль - теж солодкуватого смаку; правда, ті, хто її спробував, навряд чи встигли власноруч зробити записи в лабораторних зошитах ...
В соляних печерах, де видобувають звичану кухонну сіль, у людей з астмою та іншими бронхолегеневими захворюваннями покращується стан здоров’я, навіть коли інші методи лікування не допомагають
Екологи
Вплив на довкілля
Найбільш токсичні солі є у відходах різних галузей промисловості:
металургійна - солі важких металів;
машинобудівна - ціаніди;
Сільське господарство забруднює літосферу шляхом внесення в грунт мінеральних добрив і отрутохімікатів. Щорічно в світі випускається близько мільйона тонн пестицидів. Всі вони потрапляють в грунт. Це призводить не тільки до її забруднення, але і до погіршення якості вирощуваних культур. З мінеральних добрив найбільш небезпечними є нітратні і фосфатні.
Літосфера дуже повільно самоочищається. Процес цей набагато повільніше, ніж її забруднення. Тому наслідки забруднення літосфери розвиваються дуже швидко і незабаром можуть стати незворотними. Поступово скорочується обсяг родючих грунтів, а це означає, що сільське господарство прийде в занепад. Забруднення лісів і морів призведе до вимирання тварин і риб.
Що можна зробити
Перш за все потрібно скоротити кількість виробленого сміття та промислових відходів. Другим шляхом вирішення є раціональне знищення забруднювачів.
На сьогоднішній день побутове сміття пропонується знищувати шляхом спалювання над розплавленим металом. Вважається, що так виділення токсичних речовин відбувається менше.
Ведеться розробка низькотоксичні пестицидів і мінеральних добрив.
Радіоактивні відходи не закопують, а зберігають у спеціальних контейнерах у вигляді азотнокислої рідини. По закінченню терміну експлуатації контейнера радіоактивну рідина поміщають в новий.
Всі відходи, які можливо, піддають вторинній переробці.
Розглядається питання про переведення всіх заводів на безвідходне виробництво.
А ми повинні сортувати сміття і здавати вторинну сировину в пункти прийому










ВІРШІ
Не знаю я, що буде після нас,
в які природа убереться шати.
Єдиний, хто не втомлюється, – час.
А ми живі, нам треба поспішати.
Зробити щось, лишити по собі,
а ми, нічого, – пройдемо, як тіні,
щоб тільки неба очі голубі
цю землю завжди бачили в цвітінні.
Щоб ці ліси не вимерли, як тур,
щоб ці слова не вичахли, як руди.
Життя іде і все без коректур,
і як напишеш, так уже і буде. Л.Костенко
І смог і "СНІД" і чорний дим Бхопала
В Червоній книзі сірі журавлі
Не бійтеся ліси
іще не все пропало
Останній вільний зубр ще ходить по землі Ліна Костенко
Отрывок из монолога царя зверей
Будут жить на бетонном безмолвье одни слизняки.
Океан разольется огромной протухшею лужей!
Я тебя не пугаю. Но очень уж сети крепки.
И растет скорострельность твоих замечательных ружей.
Так устроена жизнь. Мы поладить с тобой не смогли.
Нашу поступь неслышную тихие сумерки спрячут.
Мы уходим в историю этой печальной земли.
Человечьи детеныши вспомнят о нас. И заплачут...
Мы --пушистые глыбы тепла.
Мы --живое зверье.
Может, правда, что день ото дня мир становится злее?..
Вот глядит на тебя Поредевшее царство мое.
Не мигая глядит. И почти ни о чем не жалея.
И совсем ничего не прося. Ни за что не коря.
Видно, в хоботы, ласты и когти судьба не дается...
Я с седеющей гривы срываю корону Царя!
И реву от бессилья... А что мне еще остается? В Маяковський
Все клонится ко сну
В желтеющей природе.
Кивает дуб клену
При солнечном заходе.
И грустно, грустно мне
Смотреть на смерть в природе
В осенней тишине
При солнечном заходе. Северянин И.
Мы купались, Загорали,
Жгли костер, В футбол играли –
Веселились, как могли!
Пили квас, Консервы ели,
Хоровые песни пели...
Отдохнули – и ушли!
И остались на полянке У потухшего костра:
Две разбитых нами склянки, Две размокшие баранки –
Словом, мусора гора!
Мы приехали на речку Понедельник провести,
Только чистого местечка Возле речки не найти! (С. Михалков)
Есть одна планета-сад В этом космосе холодном.
Только здесь леса шумят, Птиц скликая перелётных,
Лишь на ней одной цветут, Ландыши в траве зелёной,
И стрекозы только тут В речку смотрят удивлённо.
Береги свою планету – Ведь другой, похожей, нету! (Я. Аким)
Берегите землю. Берегите Жаворонка в голубом зените,
Бабочку на листьях повилики, На тропинках солнечные блики.
На камнях играющего краба, Над пустыней тень от баобаба,
Ястреба, парящего над полем, Ясный месяц над речным покоем,
Ласточку, мелькающую в жите. Берегите землю! Берегите! (М. Дудин)
Земля дымила дымом,
Земля пыхтела паром,
Земля травилась ядом
И взрывами тряслась.
Земля леса рубила,
Земля леса сжигала,
Земля леса топила,
Ну, словом, зарвалась.
Потом она спросила:
- А где же атмосфера?
Мне что-то стало душно,
Ах, мне нехорошо!
Ах, дайте кислороду
И чистенькую воду!
Нормальную погоду!
Но поезд-то ушел. (Р. Алдонина)


про публікацію авторської розробки
Додати розробку
