Урок "Повторення окисно - відновних реакцій"
9 клас
17.05.18
Урок № 66
Тема уроку: Повторення»Окисно-відновні реакції, їхнє значення».
Мета уроку:
Освітня: повторити та закріпити знання учнів про окисно-відновні реакції, складати рівняння окисно-відновних реакцій методом електронного балансу;
Розвивальна: розвивати вміння і навички роботи в команді, формувати вміння виступати перед аудиторією;
Виховна: виховувати пізнавальний інтерес учнів до вивчення хімії, товариськість і взаємодопомогу.
Хід уроку
І. Організаційний момент.
II. Мотивація навчальної діяльності.
III. Повторення вивченого матеріалу.
Правила визначення ступенів окиснення елементів:
- СО елементів у простих речовинах завжди = 0.
- СО лужних металів завжди = +1.
- СО Гідрогену в сполуках завжди = +1.
- СО Оксигену в сполуках завжди = -2.
- СО металів, які знаходяться в складних речовинах завжди = номеру групи, в якій знаходяться.
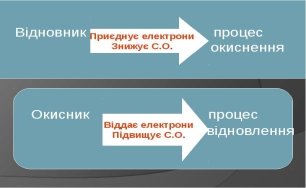
Окисники та відновники.
Окисник (процес відновлення) – віддає електрони.
Відновник (процес окиснення) – приєднує електрони.

Алгоритм складання рівнянь окисно-відновних реакцій методом електронного балансу:
1.Записати схему реакції.
2. Визначити ступені окиснення всіх елементів у кожній сполуці.
3. Позначити елементи, які змінюють ступінь окиснення внаслідок перебігу реакції.
4. Скласти електронні схеми процесів окиснення та відновлення
5. Підібрати коефіцієнти в цих схемах так, щоб загальне число електронів, які формально віддає відновник, дорівнювало загальному числу електронів, які формально приєднує окисник.
6. Надати остаточного вигляду рівнянню реакції, добираючи коефіцієнти для решти учасників реакції.
ІV. Застосування умінь та навичок
Гра «Відгадай слово»
Клас об’єднується в 4 групи, отримують на картках по 2 схеми рівнянь реакцій і методом електронного балансу підібрати коефіцієнти. Далі підсумовуються всі коефіцієнти в кожному з рівнянь. На окремих аркушах надруковані правильні суми коефіцієнтів та відповідні літери. Кожна група повинна розшифрувати по 2 літери і т.ч утвориться слово «ЕКСПЕРИМЕНТ».
Перша група – P + KClO3 = KCl + P2O5 (сума всіх коефіцієнтів складає 13)
Co + HNO3 = Co (NO3)2 + N2 + H2O (сума всіх коефіцієнтів складає 29)
Друга група – Cu + H2SO4 = CuSO4 + SO2 + H2O (сума всіх коефіцієнтів складає 14)
S + HNO3 = H2SO4 + NO2 + H2O (сума всіх коефіцієнтів складає 16)
Третя група - P + HNO3 + H2O = H3PO4 + NO (сума всіх коефіцієнтів складає 18)
Zn + HNO3 = Zn (NO3)2 + H2O + N2 (сума всіх коефіцієнтів складає 29)
Четверта група - CuS + HNO3 = CuSO4 + NO2 + H2O (сума всіх коефіцієнтів складає 22)
Mg + HNO3 = Mg (NO3)2 + N2O + H2O (сума всіх коефіцієнтів складає 20)
NH3 + O2 = NO + H2O (сума всіх коефіцієнтів складає 19)
V. Обговорення «ОВР НАВКОЛО НАС»
Заслуховуються повідомлення учнів
1. Значення окисно-відновних процесів в природі.
2. Значення окисно-відновних реакцій в житті людини.
3.Значення окисно-відновних реакцій в техніці.
4.Руйнівна роль ОВР.
VІ. Висновок
Підсумок: Крок за кроком накопичувався досвід використання окисно - відновних реакцій. Вивчення окисно-відновних процесів продовжується і в наш час. Отже, окисно-відновні процеси відіграють надзвичайно важливу роль у природі, виробництві, техніці та побуті.
VІІ. Підведення підсумків уроку.
VIІІ. Домашнє завдання.


про публікацію авторської розробки
Додати розробку
