Урок та Презентація "Закон збереження маси речовин під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння".
Про матеріал
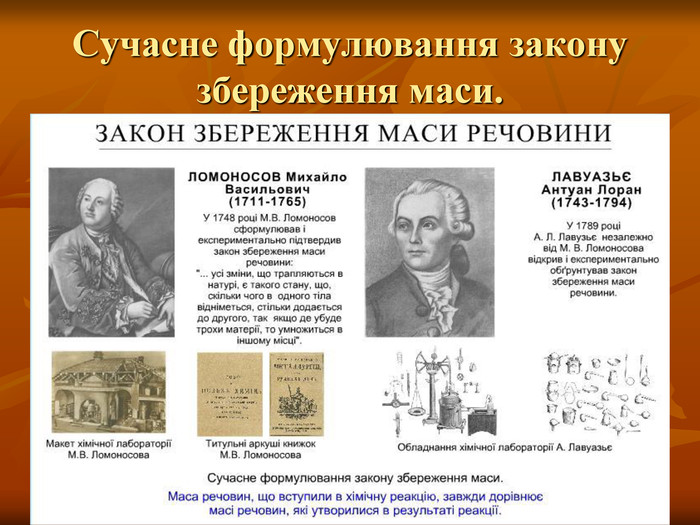
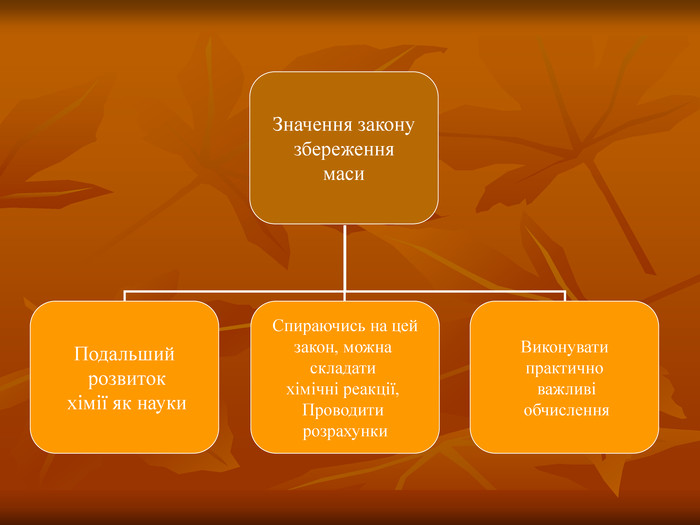
Презентація "Закон збереження маси речовин під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння" призначена для вчителів хімії, які працюють у 7-х класах.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку