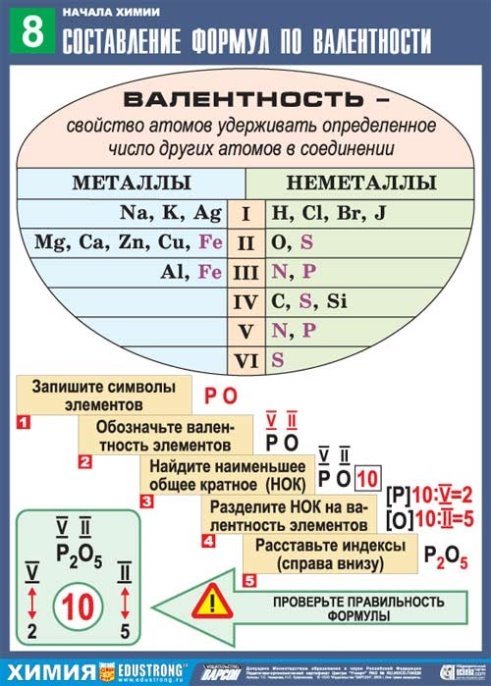
Конспект урока химии для 7 класса: "Составление формул бинарных соединений"
Комбинированный урок. Межпредметные связи наиболее выражены с математикой (наименьшее общее кратное). Очень сложная и важная тема в курсе 7 класса, так как закладываются основные закономерности протекания химических реакций на основании "Закона о постоянстве состава веществ".
Конспект открытого урока по химии для учеников 7 класса
Тема: Cоставление формул бинарных соединений по валентностям химических элементов.
Цели:
- образовательные – обобщить знания учащихся о валентности; сформировать понятие о бинарных соединениях и научиться составлять их формулы; на основании полученных знаний показать существование закона постоянства состава химических соединений;
- развивающие – развивать межпредметные связи с математикой;
- воспитательные – вызвать интерес к предмету.
Оборудование: периодическая система химических элементов Д.И. Менделеева, шаростержневые модели молекул, ноутбук, экран.
Основные понятия и термины: атом, молекула, химическая связь, бинарные соединения, валентность, химический элемент.
Тип урока: комбинированный.
Форма урока: урок с использованием видеоряда.
Методы обучения: словесные, пояснительно-иллюстративные, репродуктивные, частично поисковые, практические (выполнение заданий), интерактивные, стратегия развития критического мышления, методы самоконтроля и взаимного контроля.
Структура урока:
I. Организационный момент…………………………………………..2 мин.
II. Актуализация опорных знаний…………………………………….7 мин.
III. Изучение нового материала:
- Закон постоянства состава веществ.
- Понятие о бинарных соединениях.
- Составление формул бинарных соединений.
- Алгоритм составления формул бинарных соединений по валентности элементов.
- Правила определения валентности элементов…………………20 мин.
IV. Обобщение и систематизация знаний………………………………10 мин.
V. Домашнее задание……………………………………………………….2 мин.
VI. Подведение итогов урока………………………………………………4 мин.
Ход урока:
- Организационный момент
Приветствие.
- Актуализация опорных знаний
Определите валентность химических элементов по формулам их соединений:
NH3 FeCl3 Cr2O3 SO3 CH4 P2O5.
- Изучение нового материала
а) Закон постоянства состава веществ:
Все индивидуальные вещества имеют постоянный качественный и количественный состав независимо от способа их получения.
На основании этого закона состав веществ выражается химической формулой с помощью химических знаков и индексов.
Закон постоянства состава справедлив для веществ молекулярного строения. Наряду с веществами, имеющими постоянный состав, существуют вещества переменного состава. К ним относятся соединения, в которых чередование нераздельных структурных единиц (атомов, ионов) осуществляется с нарушением периодичности.
Однако условно для простоты состав многих таких соединений записывают как постоянный. Например, состав оксида железа(II) записывают в виде FeO (вместо более точной формулы Fe1-xO).
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г.
b) Понятие о бинарных соединениях.
|
Бинарная химическая формула – это формула химического соединения, в состав которого входят два вида атомов.
|
|||||
|
ОКСИДЫ |
СУЛЬФИДЫ |
ХЛОРИДЫ |
|||
|
Оксид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является кислород, с валентностью (II).
Na2О |
Сульфид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является сера, с валентностью (II).
K2S |
Хлорид – это сложное вещество, в состав которого входят два вида атомов, одним из которых является хлор, с валентностью (I).
FeCl3 |
|||
|
Общая формула
где Э – элемент; Х – валентность элемента |
Общая формула
где Э – элемент; Х – валентность элемента |
Общая формула
где Э – элемент; Х – валентность элемента |
|||
с) Составление формул бинарных соединений
Запомните! Особенности составления химических формул соединений.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) Атом металла стоит в формуле на первое место.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид». Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца. Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
3) Атом металла ставится в формуле на первое место.
Задание - Алгоритм
Составьте бинарные формулы соединений по их названиям: Оксид калия, сульфид алюминия, хлорид меди (II)
Решение:
|
Действие |
Примеры |
||
|
1.Записать символы
|
Оксид калия KO |
Сульфид алюминия AlS |
Хлорид меди (II) CuCl |
|
2. Проставить значения валентностей над элементами |
I II K O |
III II Al S |
II I Cu Cl |
|
3. Найти наименьшее кратное для валентностей элементов |
1·2=2 |
3·2=6 |
2·1=2 |
|
4. Путём деления кратного на значения валентностей, находим индексы элементов |
2 : I = 2 2 : II = 1
K2O |
6 : III = 2 6 : II = 3
Al2S3 |
2 : II = 1 2 : I = 2
Cu Cl2 |
IV. Обобщение и систематизация знаний.
№1. Даны химические элементы и указана их валентность. Составьте соответствующие химические формулы:
I
Li O
II
Ba O
V
P O
IV
SnO
III
P H
VII
MnO
III
Fe O
II
H S
IV
N O
III
Cr Cl
№2.
Составьте формулы молекул для следующих соединений:
1) меди и кислорода,
2) цинка и хлора,
3) калия и йода,
4) магния и серы.
№3.
Составьте бинарные формулы следующими элементами:
А) бор и кислород;
Б) алюминий и хлор;
В) литий и сера.
№4.
Составьте формулы веществ по их названиям:
оксид серы, хлорид железа (III), сульфид углерода
V. Домашнее задание: параграф №12, №3, 4, 6 на с.96; проработать конспект.
VI. Подведение итогов урока.
-
Чудовий, корисний конспект! Дякую! )))

про публікацію авторської розробки
Додати розробку