Урок "Теплові ефекти хімічної реакції. Швидкість хімічної реакції, залежність швидкості реакції від різних чинників"
Познайомити учнів з поняттям «тепловий ефект хімічної реакції», "термохімічні рівняння"; розширити уявлення про хімічні реакції на прикладі ендотермічних і екзотермічних реакцій; cформувати уявлення про швидкість хімічної реакції, її залежність від різних факторів.
9 - клас
Урок № 14
Тема: Теплові ефекти хімічної реакції. Швидкість хімічної реакції, залежність швидкості реакції від різних чинників.
Мета:
навчальна: познайомити учнів з поняттям «тепловий ефект хімічної реакції», термохімічні рівняння»; розширити уявлення про хімічні реакції на прикладі ендотермічних і екзотермічних реакцій; формувати навички і вміння складати термохімічні рівняння реакцій, розв’язувати задачі з їх використанням; cформувати уявлення про швидкість хімічної реакції, її залежність від різних факторів, поглибити знання про каталізатори та їх вплив на швидкість реакції;
розвиваюча: формувати вміння аналізувати інформацію, порівнювати, класифікувати, формулювати узагальнюючі висновки, застосовувати набуті знання на практиці та оцінювати результати виконаних дій; розвивати пізнавальні та творчі здібності учнів;
виховна: допомогти вихованню самостійності, співробітництва, здатності до взаємодопомоги.
Обладнання: періодична таблиця елементів Д.І.Менделєєва, таблиця «Розчинність кислот, основ та солей у воді», «Електрохімічний ряд напруг металів», картки самоконтролю, ноутбук, відео досліди,картки із завданнями.
Базові поняття та терміни: швидкість хімічної реакції, концентрація речовин, каталізатори, інгібітори.
Тип уроку: комбінований.
Методи навчання: пояснювально-ілюстративні - бесіда, розповідь; наочні - демонстрації; практичні - виконання вправ; інтерактивні; репродуктивні, частково-пошукові, творчі.
ХІД УРОКУ
І. Організаційний етап
Доброго дня шановні учні! Сьогодні у вас незвичайний урок, урок особливий, сповнений цікавими фактами. Надіюсь, що вам запам’ятається цей урок, і ви візьмете із нього все те, що вам знадобиться в майбутньому.
ІІ. Актуалізація опорних знань
Метод бесіди:
1. Дайте відповідь на такі запитання:
- Дайте визначення поняттю "Хімічна реакція". //Хімічна реакція – це перетворення одних речовин на інші при незмінності ядер атомів//
- Які ознаки протікання хімічних реакцій? //Виділення або поглинання тепла, світла, електричної енергії; поява чи зникнення запаху, виділення газу, випадання осаду та інше//
- Назвіть відомі вам типи хімічних реакцій. //Розкладу, сполучення, заміщення та обміну//
2. Прийом «Так чи ні»
Встановити, яке твердження вірне, а яке ні:
1. Схема А + В = АВ відповідає реакції сполучення. (так)
2. Схема АВ = А + В відповідає реакції розкладу. (так)
3. Схема А + ВС = АС + В відповідає реакції обміну. (ні)
4. Схема А В + СД = АД + СВ відповідає реакції заміщення. (ні)
5. У реакції розкладу бере участь одна складна речовина.(так)
6. У реакції обміну беруть участь дві речовини, з яких одна проста, а інша -_складна. (ні)
7. Реакція взаємодії металу з кислотою є реакцією заміщення. (так)
8. Взаємодія кислот з основами є реакцією сполучення. (ні)
3. Завдання на встановлення відповідності:
Установіть відповідність між рівнянням реакції та типом хімічної реакції:
Рівняння реакцій : Тип реакцій: :
1. 2НCl + Ca = CaCl2 + H2 ; (в) А.Сполучення.
2. 2Fe + 3Cl2 = 2FeCl3 ; (а) Б. Розкладу.
3. CuSO4 + 2NaOH = Cu(OH)2+ Na2SO4; (г) В. Заміщення.
4. Zn + H2SO4 = ZnSO4 + H2; (в) Г. Обміну.
5. 4Al + 3O2 = 2Al2O3 (а)
6. CaCO3 = CaO + CO2.(б)
ІІІ. Мотивація навчальної діяльності.
У мене до вас запитання: чим відрізняється черепаха від гепарда? (швидкість руху).
Чим відрізняється повільне окиснення від вибуху? (швидкість реакції).
Добре молодці
Під час хімічних реакцій зберігається число атомів, їхня маса, але змінюються хімічні зв’язки між атомами: одні руйнуються (при цьому енергія витрачається), інші виникають (при цьому енергія вивільняється). В результаті реакції тепло виділяється або поглинається. Саме за цією ознакою реакції поділяються на екзотермічні і ендотермічні.
Як ви вже здогадались ми з вами сьогодні познайомимося докладніше з цією класифікацією і швидкістю реакцій.
ІV. Вивчення нового матеріалу.
Розповідь вчителя з елементами бесіди.
1.Теплові ефекти хімічної реакції.
Вам відомі реакції, які відбуваються з виділенням значної кількості теплоти. Це — реакції горіння. Їх використовували люди ще в далекі часи, обігріваючи свої домівки, готуючи їжу, спалюючи деревину, рослинні залишки, вугілля. Нині сфера застосування реакцій горіння значно розширилася. Їх здійснюють на теплоенергетичних підприємствах, металургійних заводах, у двигунах внутрішнього згоряння, при використанні вогнепальної зброї, під час запусків ракет і космічних кораблів, при створенні феєрверків.
Приклади реакцій горіння:
t 4P + 5O2 = 2P2O5;
t CH4 + 2O2 = CO2 + 2H2O.
Теплота виділяється не лише при горінні речовин, а й при змішуванні розчинів лугу та сильної кислоти (внаслідок реакції нейтралізації)
NaOH + HCl = NaCl + H2O,
гасінні вапна
CaO + H2O = Ca(OH)2,
взаємодії металів з кислотами:
2Al + 6HCl = 2AlCl3 + 3H2↑.
Існують реакції, під час яких теплота поглинається. Серед них — реакції розкладу
багатьох сполук (оксидів, гідроксидів, оксигеновмісних солей, кристалогідратів):
t
2SO3 = 2SO2 + O2;
t
Pb(OH)2 = PbO + H2O↑;
t
2KNO3 = 2KNO2 + O2↑;
t
BaCl2 · 2H2O = BaCl2 + 2H2O↑.
Для того щоб такі реакції відбувалися, речовини нагрівають. Якщо нагрівання припинити, то припиняється й хімічне перетворення.
Реакції, під час яких теплота виділяється, називають екзотермічними1, а реакції, під час яких теплота поглинається, — ендотермічними2.
Метод робота з підручником
1. Знайдіть в підручнику, що називається тепловим ефектом реакції?
Тепловий ефект реакції – кількість теплоти, що виділяється чи поглинається під час хімічних реакції.
2. Тепловий ефект позначається:
а) Q – показує скільки теплоти (в кДж) виділилося або поглинулося під час реакції;
б) Δ Н – показує різницю між вмістом енергії у вихідних речовинах і кінцевих продуктах
(ентальпія)
Δ Н = - Q
3. Тепловий ефект вимірюється в Дж або в кДж
4. Знайдіть в підручникуяк називаються хімічні реакції, в яких зазначається тепловий ефект реакції?
Хімічні рівняння, в яких зазначено кількість теплоти, що виділяється або поглинається, називаються термохімічними рівняннями
Метод розповіді з демонструванням відео матеріалів

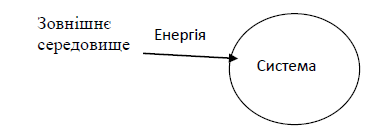
Енергія поглинається системою із зовнішнього середовища, Q ‹0. Отже, реакція ендотермічна
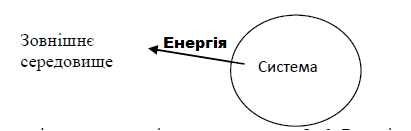
Енергія виділяється у зовнішнє середовище. Q ›0. Реакція екзотермічна
(перегляд відео)
2. Швидкість хімічної реакції
1. Вивчаючи хімічні властивості різних сполук, ви напевне звернули увагу на те, що для перебігу різних реакцій потрібний різний час:
- Іржа на залізних виробах утворюється за кілька місяців;
- Горіння свічки триває кілька годин;
- Реакція між содою і оцтом відбувається в одну мить.
2. Отже, реакції перебігають з різною швидкістю. Пригадайте, як на уроках фізики і математики, ви позначали швидкість руху? (U)
3. Швидкість хімічних реакцій вивчає розділ хімії, що називається хімічною кінетикою.
4. За якими критеріями можна судити про швидкість протікання хімічної реакції? За зміною кількості вихідних речовин і продуктів реакції.
Швидкість реакції – зміна концентрації речовини за одиницю часу.

Чому перед формулою ставлять +? Якщо швидкість обраховують за зміною концентрації вихідних речовин, то ставиться «-», бо ΔC набуває від’ємного значення, а якщо за зміною концентрації продуктів реакції, то ставиться +.
Приклад:
У закритій посудині об’ємом 1 л взаємодіють гази А і В згідно з рівнянням А+В=ВА. Концентрація газу АВ в якийсь момент часу була 0,04 моль/л, а через 50с стала 0,01моль/л. Визначити швидкість хімічної реакції?
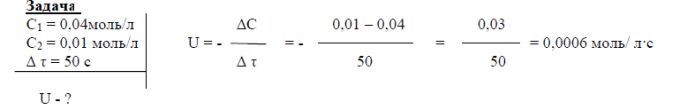
5. В житті часто виникає потреба керувати швидкістю реакції . Наприклад:
- горіння палива прискорювати;
- пожежу – сповільнювати;
- іржавіння заліза сповільнювати.
Для цього потрібно знати від чого залежить швидкість реакції.
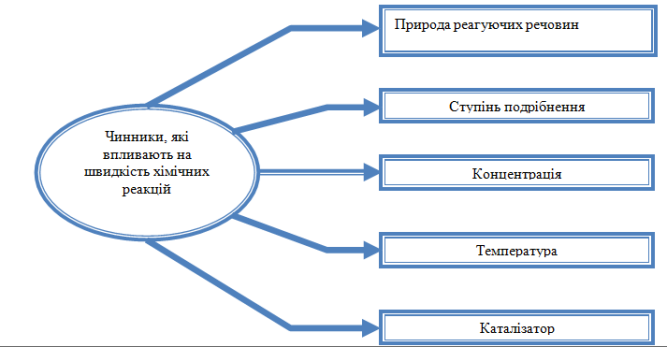
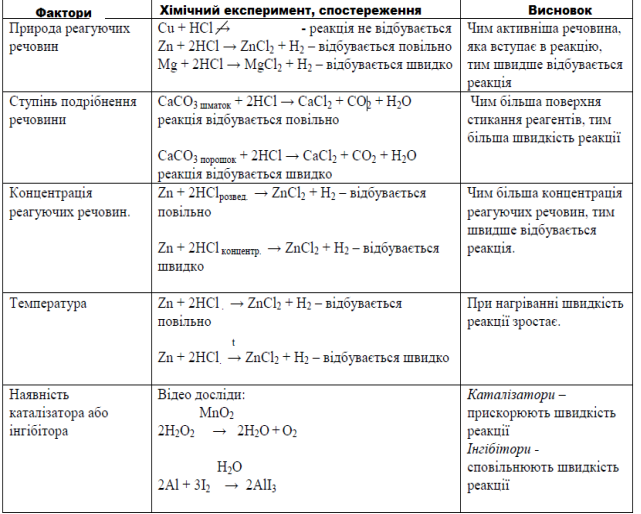
Лабораторний дослід №10
Залежність швидкості реакції від різних чинників.
Мета: дослідити вплив різних чинників на швидкість хімічної реакції.
Обладнання: гранули Mg, Zn, Cu , розведений розчин хлоридної кислоти (HCl), концентрований розчин хлоридної кислоти, шматок крейди, порошок крейди, спиртівка, сірники, тримач.
Можливі такі варіанти проведення лабораторного досліду:
1. Практичне виконання (при наявності реактивів)
2. Віртуальне виконання (перегляд відео дослідів)
Хід роботи
Метод проведення віртуальне виконання дослідів
Дослід 1. Вплив площі поверхні стикання речовин на швидкість хімічної реакції.
В одну пробірку киньте шматочок крейди, а в іншу пробірку насипте стільки ж порошку крейди. В кожну пробірку долийте розчин хлоридної кислоти. Зробіть висновок, як ступінь подрібнення речовин впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
Дослід 2.Вплив концентрації речовин на швидкість хімічної реакції
В дві пробірки киньте однакові гранули цинку. В першу пробірку налийте розведений розчин хлоридної кислоти, а в другу – концентрований розчин хлоридної кислоти. Зробіть висновки, як концентрація речовин впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
Дослід 3. Вплив температури на швидкість реакції
|
В дві пробірки киньте однакові гранули цинку. В кожну пробірку долийте розчин хлоридної кислоти. Одну з пробірок підігрійте в полум’ї спиртівки. Зробіть висновок, як температура впливає на швидкість реакції. Результати спостереження запишіть в таблиці.
|
V. Узагагальнення та закріплення знань
Закріплення набутих знань
1. (Колективна робота над виконанням тренувальних вправ)
1.) Які з наведених реакцій є екзотермічними, а які ендотермічними:
А. FeO + CO → Fe + CO2 + Q; (екзотермічна)
Б. СН4 + Н2О → СО2 + 3Н2 ─Q; (ендотермічна)
В. СаО + Н2О → Са(ОН)2 + Q; (екзотермічна)
2.) До якого типу належать реакції,що відбуваються в пробірках:
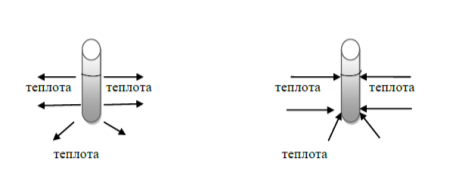
Екзотермічна реакція Ендотермічна реакції
2. Розташуйте явища за зростанням швидкості хімічних реакцій:
|
Явища |
Очікуванні відповіді |
|
|
VІ. Домашнє завдання
1. Опрацювати §16-17
2. Виконати вправи № 125, 129,130
Гра «Вірю – не вірю»
Учні зачитують твердження і дають відповідь - вірне воно чи хибне.
- Екзотермічні реакції відбуваються із виділенням теплоти. (Так)
- Ендотермічні реакції відбуваються із поглинанням теплоти. (Так)
- Реакція горіння вугілля – це ендотермічна реакція. (Ні)
- Тепловий ефект реакції – це маса продукту реакції, що утворилася під час горіння речовини. (Ні)
- Тепловий ефект реакції вимірюється в паскалях (Па), або кілопаскалях(кПа). (Ні)
- Тепловий ефект реакції позначається буквою Q або ∆Н. (Так)
- В ендотермічних реакціях внутрішня енергія речовин зростає. (Так)
- Тепловий ефект реакції – це кількість теплоти, що виділяється, або поглинається під час реакції. (Так)
- Тепловий ефект реакції вимірюється в Дж або кДж. (Так)
- Хімічні рівняння, в яких зазначаються ступені окиснення елементів, називаються термохімічними. (Ні)
- При екзотермічних реакціях температура реакційної системи підвищується. (Так)
12.Під час протікання ендотермічної реакції температура реакційної суміші підвищується. (Ні)
Розв’язавши кросворд, у виділених клітинках ви прочитаєте, що хімічне явище це…..

1. Чинник, який збільшує швидкість реакції між газами
2. Каталізатори живої природи.
3. Речовина, яка змінює швидкість реакції
4. Зміна кількості речовини в одиниці об’єму за одиницю часу
5. Вміст речовини в одиниці об’єму.
6. Дія спрямована на пришвидшення гетерогенної реакції.
7. Український вчений, який запропонував механізм гомогенно–гетерогенного каталізу


про публікацію авторської розробки
Додати розробку