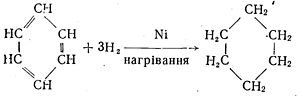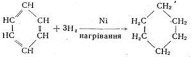Урок у 10 класі з теми "Хімічні властивості бензену"
Конспект уроку в 10 класі
на конкурс «Вчитель року – 2020»
Підготувала вчитель І категорії
Лисичанської загальноосвітньої № 14
Зінченко Нелля Василівна
Тема. Хімічні властивості бензену.
Мета: ознайомити учнів з особливостями хімічних властивостей бензену та показати їхню залежність від будови; розвивати вміння складати хімічні рівняння на прикладі властивостей бензену; формувати інтерес до предмета, заохочувати активність і самостійність, виховувати культуру спілкування і взаємоповагу при роботі у групах.
Тип уроку: комбынований
Методи навчання: словесні, пояснювально-ілюстративні, репродуктивні, частково-пошукові, практичні, інтерактивні
Базові поняття: арени, ароматичні, бензен, нітрування, галогенування, гідрування, окиснення.
Обладнання: мультимедійна презентація, тест на платформі «На урок», текст-інформаційний, картки із завданням, картки Qr-код, таблиці.
Хід уроку
І. ОРГАНІЗАЦІЙНИЙ МОМЕНТ
- привітання і знайомство з учнями
Доброго всім дня! Я, вчитель хімії Лисичанської загальноосвітньої школи № 14, Зінченко Н.В. У нас з вами сьогодні особливий день, бо не кожен раз до вас на урок приходить незнайомий вчитель, та ще й інших вчителів із собою приводить. Але у той же час це звичайний урок, бо як і ваш вчитель хімії я допоможу сьогодні вам отримати нові знання, а ви мені допоможете провести сьогоднішній урок.
- пояснення правил роботи на уроці
Ви мабуть помітили, що працювати сьогодні ми будемо по групах. Од же нам треба прийняти певні правила роботи у групах. (працювати тихо, не перебивати, слухати, записувати). З вашого дозволу я внесу одне своє правило: щойно ви почуєте мій дзвоник, це означає, що ми припиняємо роботу і слухаємо наступне завдання.
ІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Бесіда
- Яку ви зараз вивчаєте хімію? (органічну)
- Атоми яких хімічних елементів утворюють органічні сполуки? (Карбону і Гідрогену)
- А як називаються органічні сполуки, що у своєму складі мають тільки Карбон і Гідроген? (Вуглеводні)
- А які вуглеводні ви в цьому році вже вивчили? (алкани, алкени, алкини, арени)
Робота в групах 1.
Завдання. Зверніть, будь ласка, увагу! Увесь цей час перед вами знаходилися невеличкі папірці. Переверніть їх, будь ласка! Зараз ви маєте за одну хвилину визначити назву вашої групи. (Алкани, алкени, алкіни, арени)
Зараз наступне завдання: за 1 хвилину я вас попрошу написати необхідну інформацію про відповідний вуглеводень.
|
Вуглеводень |
Алкани |
Алкени |
Алкіни |
Арени |
|
Загальна формула |
СпН2п+2 |
СпН2п |
СпН2п-2 |
СпН2п-6 |
|
Представник |
СН4 |
С2Н4 |
С2Н2 |
С6Н6 |
|
Валентний кут |
109о28
|
120о |
180о |
120о |
|
Тип зв’язку |
ɗ-зв'язок |
ɗ-зв'язок 1ԉ-зв'язок |
ɗ-зв'язок 2ԉ-зв'язки |
ɗ-зв'язок 6-ти електронний ԉ-зв'язок |
|
Довжина зв’язку |
0,154 нм |
0,134 нм |
0,120 нм |
0,140 нм |
|
Характерні хімічні реакції
|
+
|
+ |
+ |
|
|
Відношення до калій перманганату та бромної води. |
Не знебарвлює |
знебарвлює |
знебарвлює |
|
Бесіда з групами по плану таблиці на слайді з’являються відповідні графи.
У мене питання до групи «Арени»
- Що вам заважало отримати повну інформацію? Чого ви ще не знаєте? (хімічні властивості бензену)
- Ви вже мабуть здогадалися, якою буде тема нашого уроку? (Хімічні властивості бензену. Записати тему уроку на дошці)
ІІІ. МОТИВАЦІЯ УЧНІВ
Розповідь вчителя.
Увага на екран!
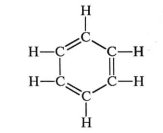
Бензен — перший із відкритих людиною аренів. У чистому вигляді він був виділений Майклом Фарадеєм у 1825 році. І тільки через 40 років (у 1865 році) Кекуле запропонував для бензену структурну формулу.
- Але що ж може буте спільного між токсичним та канцерогенним бензеном і корисним грейпфрутом?
- І чи можливо провести аналогію між аренами і наприклад… окапі?
І про все це у найближчі 30 хв.
ІV. ВИВЧЕННЯ НОВОЇ ТЕМИ
Бесіда.
- Вивчаючи хімічні властивості речовини треба згадати від чого вони залежать? (від будови)
- Звертаємо увагу на попередню таблицю. І давайте поміркуємо. У які реакції будуть вступати арени? (припущення учнів)
- Демонстрація досліду «Знебарвлення калій перманганату та бромної води»
Чому не знебарвлюються? У бензена немає кратних зав’язків?
- Щоб це перевірити, я пропоную вам, ще трішки попрацювати у групах. На партах кожної групи ви знайдете QR-коди, розшифрувавши які ви отримаєте завдання.
Робота в групах 2
І група. Взаємодія з бромом (галогенування)
ІІ група. Взаємодія з нітратною кислотою (нітрування)
ІІІ група. Взаємодія з гідрогеном (гідрування)
ІV група. Взаємодія бензену з хлором
Завдання.
- Розглянути відповідну частину матеріалу
- Записати відповідну реакцію
- Розібратися і потім пояснити, яким чином відбувається приєднання або заміщення
- Назвати продукти реакції
- За яких умов відбувається реакція
- Визначити тип даної реакції
Текст для роботи груп
Хімічні властивості
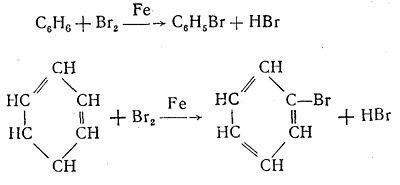
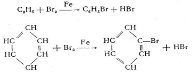
1. Взаємодія з бромом. (галогенування) Незважаючи на те, що в молекулі бензену є три подвійних зв'язки, тобто що він належить до дуже ненасичених вуглеводнів, для нього більш характерні не реакції приєднання, а реакції заміщення. На відміну від ненасичених вуглеводнів бензен з бромною водою не реагує. Але з бромом у присутності заліза як каталізатора він реагує з утворенням монобромобензену:
При цьому, як видно з реакції, атом Брому не приєднується до молекули бензену за місцем розриву подвійного зв'язку, як це спостерігається в ненасичених вуглеводнів, а заміщує атом Гідрогену, що характерне для насичених вуглеводнів. Це явище обумовлюється особливістю будови молекули бензену й її симетричністю.
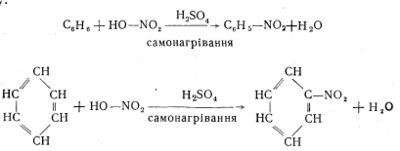
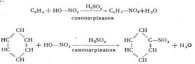
2. Взаємодія з нітратною кислотою. Характерною для бензену є реакція нітрування, тобто взаємодія його з концентрованою нітратною кислотою в присутності концентрованої сульфатної кислоти як водовіднімаючого засобу з утворенням дуже важливого хімічного продукту нітробензену
3. Взаємодія з воднем. Бензен вступає і в реакції приєднання, але значно важче, ніж у реакції заміщення. При цьому він виявляє властивості ненасичених вуглеводнів. Так, у присутності нікелевого каталізатора і при нагріванні бензен реагує з воднем з утворенням циклогексану:
При цьому атоми Гідрогену приєднуються молекулою бензену за рахунок розриву подвійних зв'язків.
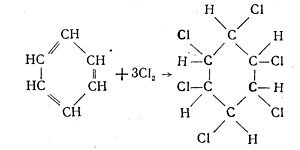
4. Взаємодія з хлором. Бензен вступає також у реакцію приєднання і з хлором під впливом світла (опромінення ртутно-кварцевою. лампою) з утворенням гексахлорциклогексану:
5. Горіння бензену. На повітрі бензен горить сильно кіптявим полум'ям, оскільки вміст Карбону у ньому значний. Суміш пари бензену з повітрям вибухова.
До дії окисників бензен досить стійкий. На нього ні бромна вода, ні розчин KMnO4 не діють.
Робота учнів 5 хв. результати записують у таблицю на дошці (15 хв)
|
1.Взаємодія з бромом (бромування)
Відбувається у присутності каталізатора Fe, FеВг3 Реакція заміщення |
5. Горіння бензену
Горить яскравим полум’ям Відбувається повне сгорання Утворюється велика кількість сажі
|
3. Взаємодія з воднем (гідрування)
Відбувається у присутності каталізатора Ni, при сильному нагріванні і високому тиску Реакція приєднання |
|
2.Взаємодія з нітратною кислотою (нітрування)
Відбувається у присутності каталізатора конц. Н2SO4; відбувається самонагрівання Реакція заміщення |
|
4. Взаємодія з хлором
Відбувається у присутності каталізатора, при температурі і під дією світла Реакція приєднання |
|
Висновки: 1. Міцний 6-ти електронний ԉ-в’язок, 2. Подвійний зв'язок не розривається 3. Стійке бензойне кільце 4. Вступають в реакції заміщення |
Висновки : 1. Як і всі органічні речовини яскраво горить 2. За рахунок наявності 6 атомів карбону утворюється сажа
|
Висновки: 1 При дуже жорстких умовах кратні зв’язки бензойного ядра можуть руйнуватися 2. Можуть вступати в реакції приєднання |
Од же давайте зробимо загальний висновок, у які типи реакцій здатен вступати бензен? (заміщення, приєднання)
Робота в групах 3
Утворення двох груп (2 хв.)
І група Порівняти насичені вуглеводні й бензен
ІІ група Порівняти ненасичені вуглеводні й бензен
- Що спільного?
- Чим відрізняються?
Висновок: Бензен схожий і на насичені вуглеводні і на ненасичені. А як ми назвемо такі речовини, що мають поєднання властивостей. (повернутися до слайду про гібриди) Бензен має гібридні властивості.
- Так чим же він схожий на грейпфрут і на окапі? (Вони також гібриди)
V. ЗАКРІПЛЕННЯ ЗНАНЬ
Виконання тестової роботи
VІ. ДОМАШНЄ ЗАВДАННЯ
- Опрацювати відповідний параграф
- Знайти інформацію про використання в побуті речовин в основі яких є бензен, його похідні та гомологи
VІІ. Рефлексія
На стінах в різних містах є висловлювання видатних людей та філософів
Роздивіться будь ласка, подумайте, та оцініть свою діяльність на уроці зянявши місце біля відповідної таблички.
- Найбільша розкіш – це насолода розуміння. Л. да Вінчі
- Єдиний шлях, який веде до знань – це діяльність. Б. Шоу
- Тільки той, хто робить, чомусь навчиться. Б. Лі
- Знання збираються по краплині, як вода в долині. Українське прислів’я


про публікацію авторської розробки
Додати розробку