Урок у 7 класі "Періодична система хімічних елементів Д.І. Менделєєва. Структура періодичної системи"
Урок № ____ Клас:____
Тема: Періодична система хімічних елементів Д.І. Менделєєва. Структура періодичної системи.
Мета: познайомити учнів із структурою періодичної системи хімічних елементів Д.І. Менделєєва і формувати навички визначення положення хімічного елемента у періодичній системі; закріпити вміння характеризувати будову атома, користуючись періодичною системою; розвивати пам’ять та увагу; виховувати допитливість.
Тип уроку: засвоєння нових знань
Обладнання: періодична система хімічних елементів; портрети Я. Берцеліуса, І. Деберейнера, Л. Мейера, Дж. Ньюлендса; карточки із завданнями.
Базові поняття й терміни: періодична система хімічних елементів, група, період, ряд.
Методи навчання: бесіда; розповідь вчителя; робота з підручником; виконання усних і письмових вправ.
Література:
- Попель П.П., Крикля Л.С. Хімія: підруч. для 7 кл. загальноосвіт. навч. закл. – К. : ВЦ «Академія», 2015. – 45-48 с.
- Григорович О.В. Хімія: підруч. для 7 класу загальноосвіт. навч. закл. / О.В. Григорович. – Х.: Вид-во «Ранок», 2015. – 64-68 с.
Хід уроку
І. Організаційний етап
Привітання учнів, перевірка готовності до уроку.
ІІ. Актуалізація опорних знань
- Перевірка домашнього завдання (виконання письмової вправи− стор. 48 № 44)
- Хімічний диктант
1. Назва простої речовини Гідрогену − … (водень)
2. Символ хімічного елемента Сульфуру … (S)
3. Позитивні і негативні бувають … (йони)
4. Вид атома з певним зарядом ядра … (хімічний елемент)
5. Назва простої речовини Карбону − … (вуглець)
6. Заряд ядра завжди … (позитивний)
7. Атом не має … (заряду)
8. Хімічний знак елемента Фосфору … (Р)
9. Атом складається з позитивного зарядженого ядра та …(негативно заряджених електронів)
10. Оксиген утворює просту речовину … (кисень - О2)
11. Протони мають заряд … (+1)
12. Електрони мають заряд … (-1)
- Бесіда
- Що називають атомом?
- Що називають молекулою?
- Чим атом відрізняються від молекули?
- Що таке хімічний елемент?
- Як поділяють хімічні елементи?
- Чому дорівнює порядковий номер хімічного елемента?
ІІІ. Мотивація навчальної діяльності
Створення і обговорення проблемного питання: «Діти, як ви гадаєте, чому в назві «Періодична система хімічних елементів» є таке слово як «система», а іноді ми говоримо просто «таблиця» або «таблиця Менделєєва»?
IV. Вивчення нового матеріалу
Розповідь учителя
Перші спроби класифікації хімічних елементів
|
Я. Берцеліус |
Й. Деберейнер |
Л. Мейер |
Дж. Ньюлендс |
|
Розподілив елементи на метали й неметали |
Розподілив елементи за валентністю |
Один з перших, хто запропонував періодичну систему елементів. Склав таблицю, де було розміщено 28 елементів у шість рядів згідно з їхньої валентністю. |
Розташував хімічні елементи за порядком збільшення атомної маси по 8 елементів. |
Дмитро Іванович Менделєєв розташував елементи в певному порядку – збільшення відносної атомної маси. Періодична система була складена на основі періодичного закону, відкритого в 1869 році Д. І. Менделєєвим. Періодичний закон ми розглянемо трохи пізніше, а до Періодичної системи звертатимемося впродовж усього курсу вивчення хімії. На момент створення Періодична система містила лише 63 елементи — саме стільки їх було відкрито на той час. У міру відкриття нових елементів вона доповнювалася новими даними. На честь Д. І. Менделєєва хіміки називають Періодичну систему його ім’ям. Геніальність Д. І. Менделєєва
полягала в тому, що він передбачив існування невідкритих на той час елементів і залишив для них вільні місця в таблиці.
Сьогодні до Періодичної системи внесено 118 елементів. Вона поповнюється щойно відкритими елементами, і поки що вчені не можуть однозначно стверджувати, скільки всього елементів може існувати.
Структура періодичної системи
Періодична система хімічних елементів має вигляд таблиці. Елементи в ній розташовані в певному порядку — у міру збільшення маси їхніх атомів. Кожний елемент має свій порядковий номер, і цей номер дорівнює заряду ядра атомів цього елемента. Існує багато різновидів зображення Періодичної системи: кругові, спіральні, пірамідальні, із розташуванням елементів зверху вниз і зліва направо. Найбільш загальноприйнятим є зображення у вигляді таблиці з розташуванням елементів зліва направо.
У Періодичній системі всі елементи об’єднані в періоди — горизонтальні ряди елементів, і групи — вертикальні ряди елементів. У довгому варіанті Періодичної системи елементи об’єднані в 7 періодів і 18 груп, а в короткому — також у 7 періодів, але у 8 груп. У нашій країні традиційно користуються короткоперіодним варіантом.
Міжнародне товариство IUPAC* рекомендує для використання довгоперіодний варіант Періодичної системи. Перші три періоди називають малими, оскільки в них міститься невелике число елементів: у першому періоді містяться тільки 2 елементи (Гідроген і Гелій), а в другому і третьому — по 8 елементів. Решту періодів називають великими: у четвертому і п’ятому періодах містяться по 18 елементів, а у шостому і сьомому — по 32 елементи. Групи об’єднують елементи з подібними властивостями. Деякі групи елементів мають назви, наприклад, група лужних елементів або група інертних елементів. У нижній частині таблиці розташовані родини елементів — лантаноїди та актиноїди. Ці елементи розміщені після Лантану (№ 57) й Актинію (№ 89) і формально належать до третьої групи. Проте розміщення цих елементів у таблиці зробило б її громіздкою і незручною, тому їх зазвичай виносять за її межі. Кожний елемент має свою «адресу» в Періодичній системі.
Щоб описати місце елемента в Періодичній системі, треба назвати його порядковий номер, а також номер групи та періоду. Наприклад: елемент Оксиген має порядковий номер 8, розміщений у другому періоді, шостій групі.
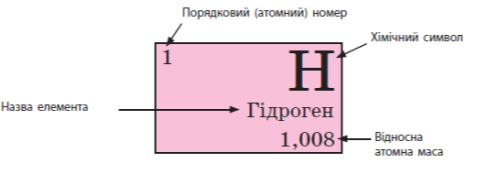
Елементи, так само як речовини або молекули, мають певні властивості. Найважливіші характеристики елементів, наведені в Періодичній системі, — це порядковий номер, відносна атомна маса тощо.
|
|
Структура періодичної системи
|
Групи |
|
Періоди |
![]()
![]()
![]()
![]()
|
Головні підгрупи |
|
Побічні підгрупи |
|
Великі |
|
Малі |
Період – це горизонтальний ряд хімічних елементів, який починається лужним металічним елементом, а закінчується інертним газом.
Група – це вертикальний стовпчик хімічних елементів, які мають однакову вищу валентність.
V. Узагальнення та систематизація знань
Завдання: серед наведеного переліку виберіть зайвий елемент і поясніть свій вибір.
а). Li, K, Ca, Cs
б). С, Si, Ti, Ge
в). K, Sc, Mn, Cl
Робота на карточках
Карточка № 1
|
Назва |
Символ |
Порядковий номер |
Період |
Група |
|
Алюміній |
|
|
|
|
Карточка № 2
|
Назва |
Символ |
Порядковий номер |
Період |
Група |
|
Оксиген |
|
|
|
|
Карточка № 3
|
Назва |
Символ |
Порядковий номер |
Період |
Група |
|
Натрій |
|
|
|
|
Карточка № 4
|
Назва |
Символ |
Порядковий номер |
Період |
Група |
|
Карбон |
|
|
|
|
Карточка № 5
|
Назва |
Символ |
Порядковий номер |
Період |
Група |
|
Нітроген |
|
|
|
|
VI. Підведення підсумків уроку
Підбиття підсумків уроку, виставлення оцінок.
Учні доповнюють речення: «Мені запам’яталось…»
VII. Домашнє завдання
Опрацювати параграф 6 (стор. 45-48); виконати завдання № 46 (стор. 48).
Додаток до уроку
Єнс Якоб Берцеліус – шведський хімік

Йоганн Вольфганг Деберайнер – німецький хімік
– німецький хімік
Лотар Юліус Мейер – німецький хімік

Джон Ньюлендс – англійський хімік

Дмитро Іванович Менделєєв – російський хімік



про публікацію авторської розробки
Додати розробку
