Урок з хімії "Фосфор - життєвонеобхідний або - небезпечний"
Урок з хімії
Вчитель : Ступак А.В., КЗ «Ліцей №3 Кам’янської міської ради»
Тема : Фосфор - життєвонеобхідний або - небезпечний.
Мета:
Навчальна: вивчення будови, властивостей, біологічної ролі, практичного значення Фосфору та його неорганічних сполук;
Розвиваюча: розвивати логічне мислення, інтелектуальні здібності та стійкий інтерес до вивчення біології, інформатики, фізики, математики та хімії, вміння аналізувати, встановлювати причинно-наслідкові зв’язки, порівнювати та узагальнювати інформацію; вдосконалювати практичні вміння та навички учнів працювати з підручником та іншими джерелами знань; формувати вміння застосовувати теоретичні знання в проектній діяльності, навички критичного мислення під час роботи з відео, фотографіями та медіатекстами
Виховна: виховувати розуміння значення «норма» використання Фосфору та його сполук для збереження здоров'я людини; сприяти формуванню
навичок партнерського спілкування між дівчатами і хлопцями; формувати
соціокультурні, інформаційні, гендерні та логічні компетентності.
Реалізація наскрізних ліній: Громадянська відповідальність, Екологічна безпека та сталий розвиток, Здоров’я і безпека
Тип уроку: STEM-урок, проект
Обладнання: засоби ІКТ : мультимедійний проектор, ноутбук, планшети;
роздатковий матеріал : картки з QR-кодами; картки з формулами хімічних сполук; малюнки; картки для проведення лабораторного досліду;
демонстраційний матеріал;
лабораторне обладнання та реактиви: штативи з пробірками,
розчини мила, кальцинованої соди, гірчичний порошок, сік лимона, оцет
Візуальний супровід: презентація Power Point
Програмне забезпечення: програма для створення презентацій Power
Point, генератор QR кодов QR Coder; сканер QR кодов (мобільний додаток ) ; онлайн-тести «Classtime»; онлайн додаток для створення 3D – моделей атомів та молекул «Avogadro»
Використання ресурсів : Цифрова освіта та навчання від Mozaik https://www.mozaweb.com/uk/Extra-3D_sceni-Bilij_fosfor_P-14583; Вікіпедії
Ми не можемо керувати природою
інакше, ніж підкоряючись їй.
Френсіс Бекон
Хід уроку
І. Організаційний етап
Звернення вчителя: Доброго дня! Я попрошу першими встати уважних і
чуйних, другими – сердечних і щирих. Ви завагалися? Чому? Тому, що ваші
серця переповнені і одним, і другим. Для того, щоб наша співпраця стала
дружньою та згуртованою, а всі ми мали хороший настрій, поверніть, будь
ласка, руки долонями один до одного й передайте тепло свого серця, своєї
душі іншим
ІІ. Перевірка домашнього завдання й актуалізація опорних знань
Обговорення запитань:
1. В якому році був відкритий фосфор?
А) 1669 р Б) 1668 р. В) 1658 р. Г) 1659 р.
2) Що означає Фосфор?
А) «той, що породжує воду» Б) «той, що носить світло»
В) «той, що гасить світло» Г) «той, що дарує світло»
3) Розмістіть реагенти в послідовності їх можливого перетворення:
А) ортофосфатна кислота Б) фосфорит
В) фосфор Г) фосфор (V) оксид
бвга
4) Фосфіди добувають нагріванням металів з фосфором. Складіть формули фосфідів кальцію та алюмінію. (Ca3N2, AlN)
5) Які сполуки входять до складу АТФ?
А) азотиста основа аденіну Б) вуглевод рибоза
В) три молекули фосфорної кислоти Г) гліцерин
Д) амінокислота (а, б, в)
ІІІ. Мотивація навчальної діяльності
Людство неодноразово переживало фосфорні аварії (США (1984), Казахстан (1988), Росія (2004), Китай (2007), Україна(2007) свого часу висвітлені в мас-медіа. Фосфорну зброю всупереч міжнародній конвенції застосовували під час нещодавніх військових конфліктів на Близькому сході (Ірак, Сирія, Ізраїль). Існують докази, що російські окупанти вже неодноразово скидали на українські міста фосфорні бомби (2022) . Докладно вивчено особливості екологічної катастрофи, викликаної потраплянням елементарного фосфору у водойми, а також наслідки для довкілля застосування фосфору як військової зброї. Сьогодні нам треба з’ясувати, чи потрібні знання про хімічний елемент та його властивості для вирішення екологічних та гуманітарних проблем людства.
Методичний коментар. Працюючи над STEАM - уроком, були сформовані домашні групи, які вчилися працювати в команді, самостійно здобувати знання і набувати відповідні компетентності. Це – «Science» (біологи, хіміки, фізики,екологи), «Technology» (Web-дизайнери, програмісти), «Engineering» (технологи), «Mathematics» (математики) Arts (літературознавці, художники ) . Учнівство, використовуючи мережу Інтернет й друковані джерела, збирали інформацію, користуючись інструктивною карткою вчителя. Матеріал діти аналізували, критично порівнювали, ущільнювали, оскільки несистематизована інформація перетворюється на хаос. Школярки та школярі готували доповіді, презентації, відео та досліди, консультуючись з вчителем
ІV. Засвоєння нового матеріалу
Вступ.
Однією із задач освіти є формування екологічної свідомості. Це не тільки любов і дбайливе ставлення до живої природи, але почуття особистої відповідальності за те, що відбувається навкруги, потреба діяти.
До кінця XX століття забруднення навколишнього середовища відходами, викидами, стічними водами всіх видів промислового виробництва, сільського господарства, комунального господарства міст набуло глобального характеру і поставило людство на грань екологічної катастрофи. Не обійшли ці проблеми стороною і Україну. Екологічні проблеми виникли не сьогодні. Тому звертаючи увагу на екологію, людина намагається зберегти саму себе. Але без зміни свідомості всі грандіозні плани збереження природного середовища будуть марними.
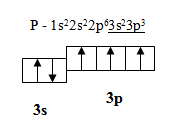
Зараз «Хіміки» ознайомлять вас з положенням в Періодичній системі хімічних елементів Д. І. Менделєєва та атомною будовою Фосфору, а ваша задача скласти модель атома за допомогою «Технологів» та записати електронно-графічну формулу і з’ясувати можливі ступені окислення у сполуках з іншими хімічними елементами.(робота в групах)
На допомогу вам матеріали: Цифрова освіта та навчання від Mozaik (https://www.mozaweb.com/uk/Extra-3D_sceni-Bilij_fosfor_P-14583)
Наступними запрошуються «Лірики»
(вам потрібно написати на листочках відповідь, з якого оповідання ці строчки і бажано написати автора)
«Юнак Фосфор зодягнув блискуче озброєння, що відігравало тисячею різнокольорових променів, і воював з драконом, який своїми чорними крилами бив по панциру...»
(Т.А. Гофман «Золотий горщик»).
«У Лондоні був туманний день, і туман лежав густий та темний. Наче жива істота, збуджений Лондон, із червоними очима та запаленими легенями, моргав, чихав і задихався. Навіть за містом стояв туманний день, проте там туман був сірий, а в Лондоні він був темно-жовтим на окраїні, бурим у міській межі, ще далі – темно-бурим, а в самому серці Сіті, званому Сент-Мері-Екс, – іржаво-чорним. З будь-якого пункту гряди пагорбів на півночі можна було помітити, що найвищі будівлі ніби намагаються час від часу пробити головою море туману і що особливо завзято «впирається» купол Святого Павла; але нічого цього не було видно біля їх підніжжя, на вулицях, де вся столиця здавалася суцільною масою туману, наповненою глухим стукотінням коліс, із прихованою у собі велетенською нежиттю»
(Чарльз Діккенс «Наш спільний друг»).
 Звернення вчителя. Перегляньте за допомогою QR коду відео та поясніть ,які помилки зробив автор з хімічної точки зору.
Звернення вчителя. Перегляньте за допомогою QR коду відео та поясніть ,які помилки зробив автор з хімічної точки зору.
Ознайомтеся з текстом про цю подію, розташованим нижче відео, та скажіть, чи знайшли ви неправдиву інформацію? Дослідить обраний уривок :
- Чи відомий автор інформації? Наскільки ви довіряєте автору? Які джерела використовує автор? Чи автор посилається на неперевірені джерела?
«Так! Це був пес, величезний, чорний, неначе смола. Такого собаки ніхто з нас, смертних, і не бачив. З його розкритої пащі виривалось полум’я, очі метали іскри, по морді й загривку переливався мерехтливий вогонь. Жоден запалений мозок не вигадав би явище страшніше, мерзенніше цього пекельного створіння, що вискочило на нас з-за туману… Його величезна паща все ще світилася блакитним полум’ям, глибоко посаджені дикі очі були обведені вогняними колами. Я торкнувся цієї голови, що світилася, й віднявши руку побачив, що мої пальці теж світилися у темряві. – Фосфор, – сказав я». (Артур Конан Дойл «Собака Баскервілів»)
«Фізики» нам розкажуть, як працює фосфор не на користь людству.
Фосфор - що це за зброя, як вона діє та що робити в разі ураження. Говорячи про зброю з білим фосфором, найчастіше згадують фосфорні бомби. Але цією речовиною можуть начинятися міни, артилерійські снаряди, ракети і гранати. Щодо фосфорної бомби, то її найчастіше начиняють тисячами маленьких кульок із фосфором. Її підривають на висоті 200-250 метрів і завдає великої шкоди не лише техніці, але й живій силі.
Завдання, опрацювати матеріали з Вікіпедії (https://uk.wikipedia.org/wiki/Фосфорний_боєприпас) та створити пам’ятку дій у разі потрапляння фосфорного боєприпасу.
- Щоб загасити білий фосфор, який потрапив на предмети, їх потрібно рясно полити водою, можна також засипати ґрунтом чи піском - це перекриє доступ кисню.
- Якщо є така можливість, занурити частину тіла, уражену фосфором, у воду.
- В жодному разі не можна використовувати вату та перекис водню. (Коли перекис водню розпадається, то утворюються вода та кисень, а кисень викликає повторне загоряння фосфору).
-
 Якщо людина перебуває при тямі, їй обов'язково потрібно дати заспокійливі та знеболювальні засоби.
Якщо людина перебуває при тямі, їй обов'язково потрібно дати заспокійливі та знеболювальні засоби.
- Коли білий фосфор горить, то виділяє отруйні пари, щоб вивести з організму токсичні речовини знадобиться будь-який сорбент.(Активоване вугілля тощо)
- Людина, яка зазнала значного впливу фосфором, повинна пити багато води, молока та лужної негазованої води.
Пропоную відсканувавши QR код, переглянути відео дослід про властивості деяких адсорбентів, зробивши висновок, який з них найбільш ефективний.
Сьогодні на уроці ми з вами будемо виготовляти лепбук за схемою. Допоможуть нам у цьому група «Технологи».
Звернення вчителя. Працюємо в групах. Кожна група виконує частину лепбуку, запропоновану технологом.
Вчитель зазначає пункти які повинен містити лепбук, а учні діляться на групи які будуть шукати та аналізувати інформацію по певному з пунктів.
Методичний коментар. Лепбук – це не просто витвір. Це заключний етап самостійної дослідницької роботи, яку дитина виконувала у ході вивчення даної теми. Щоб заповнити цю папку, дитині потрібно виконати певні завдання, провести спостереження, вивчити представлений матеріал [6]. Створення лепбуку допоможе закріпити і систематизувати вивчений матеріал, а розглядання папки в подальшому дозволить швидко освіжити в пам’яті пройдені теми. Він допомагає дитині та вчителю по своєму спільному бажанню організувати інформацію з вивченої теми і краще зрозуміти та запам’ятати матеріал. Це гарний спосіб для повторення пройденого [7] . Це завдання може бути використане в якості домашнього завдання)
1. Цікаві факти про Фосфор
2. Будова молекули, алотропні видозміни та їх особливості
3. Вміст в живих організмах
4. Сполуки Фосфору в продуктах харчування
5.Наслідки використання сполук Фосфору людиною.
Велика частина фосфору надходить в наш організм з продуктами харчування, і в невеликих кількостях – з водою. В організмі 85% Фосфору знаходиться в кістках, невелика кількість в м'язовій тканині і крові. У порівнянні з іншими мікроелементами, Фосфор відносно добре засвоюється організмом.
«Математик» . Розв’яжіть задачу.
Рекомендований рівень споживання Фосфору залежить від віку і статі:
• Від 9 до 18 років – 1250 мг на день.
• Від 19 до 50 років – 700 мг на день.
Розрахуйте скільки треба вжити насіння соняшнику, щоб задовольнити потребу організму у фосфорі. (І група –для дітей та підлітків, ІІ група –для дорослих)
Насіння: в 100 грамах насіння кавуна – понад 1200 мг Фосфору. Також багате на фосфор насіння соняшнику- 990 мг , насіння кунжуту- 760 мг, насіння льону та насіння Чіа (іспанська шавлія)- 540 мг.
Продукти з високим вмістом фосфору : горіхи, риба і морепродукти, м’ясо,
молоко, сири, соєві продукти, бобові та яйця
Для підсилення смаків та покращення вигляду продуктів харчування часто застосовують харчові добавки. Надаємо слово «Програмістам» й спробуємо відгадати, яка неорганічна речовина використовувалась людством в якості першої харчової добавки.
«Програмістка». Ця речовина пропускає ультрафіолетові промені. Її
прозорі кристали використовують в оптичних приладах . Один кристал здатен
запам’ятати до 1 млрд. байт інформації завдяки складним процесам, які
проходять під дією сонячного світла. Можливо, ця речовина – майбутнє
комп’ютерів?
Web-дизайнер демонструє ребус, щоб учні швидше здогадались.

(Кухонна сіль (NaCl )).
Тема використання фосфатних добавок до харчових продуктів на сьогодні не впорядкована. Тому багато виробників зловживають цим. Тому треба ураховувати, що надлишок фосфору провокує не менше проблем, ніж їх знижений вміст. Постарайтесь виключити з свого раціону кока колу і схожі газовані солодкі напої. В них фосфати використовують як підкислювачі. Також не вживайте консервованих фруктів та овочів – в них фосфати додають як ущільнювачі. Зменшить вживання ковбасних виробів. Багато фосфатів у чіпсах. Для зростаючого організму підвищення кількості фосфору за рахунок надходження з м’ясних, рибних та рослинних продуктів необхідне, але вживання продуктів з фосфатними добавками дуже шкідливе. Це може спровокувати збудження нервової системи. Небезпека в тому, що штучно внесені фосфати 100 % поглинаються організмом. Автоматичний бар’єр, який регулює поглинання натуральних фосфатів тут не працює. У цьому і полягає небезпека вживання продуктів з штучно внесеними фосфатами.
До слова запрошуються «Екологи»
Докладно вивчено особливості екологічної катастрофи, викликаної потраплянням елементарного фосфору у водойми, а також наслідки для довкілля застосування фосфору як військової зброї. В 50-х роках минулого століття закордонні хіміки одержали ефективні миючі засоби на основі фосфатів, які почали широко використовувати для прання, миття посуду, чистки побутових речей. Відношення до цих засобів побутової хімії було надзвичайно схвальним, на рівні ейфорії. Але приблизно через десять років після їх розповсюдження перші сигнали про небезпеку пролунали від лікарів. Вони доповідали про незвичайне зростання кількості захворювань серцево судинних органів та скелету. Одночасно екологи- дослідники стану водойм стали свідчити про швидку зміну водойм, перетворення озер та малих річок на болота. Співставлення ситуації в медицині та екології довели, що причиною цих нібито різних явищ є використання фосфатів у промисловості і особливо у побуті. Ні для кого не секрет, що намагаючись зберегти час і гроші при виборі миючих засобів, насправді ми економимо лише на своєму здоров'ї. Адже всього століття тому люди широко використовували натуральні рослинні компоненти, соки і масла для догляду за тілом, волоссям, прання білизни тощо. Замість того, щоб щодня піддавати хімічній атаці фосфатів, барвників та ароматизаторів як себе, так і планету, чи не краще згадати про корисні властивості рослин, здатних утворити не менш ефективну і нешкідливу мильну піну.
Пропоную виконати дослід : Безпечні засоби для миття посуду та прання одягу. (Робота в групах)
1.Господарське мило — одне з кращих універсальних засобів, який може впоратися з багатьма завданнями, завдяки чому його можна використовувати як для миття посуду, так і для прання одягу.
2. Засіб для миття посуду з теплого мильного розчину з додаванням гірчичний порошку.
3.Пральний порошок з кальцинованої соди та подрібненого на тертці мила. (Однак слід пам’ятати, що кальцинована сода — їдка речовина, для захисту рук використовуйте рукавички.)
4.Для видалення плям з одягу - сік лимона або оцет.
V. Узагальнення та закріплення знань
1. Робота з медіатекстом.
Клас об’єднується у 2 групи
Групи опрацьовують медіатекст, на основі якого створюють ментальні карти :
І група – «Фосфор та його сполуки»;
ІІ група – «Застосування Фосфору».
Групи представляють свої ментальні карти.
Медіатекст за посиланням https://uk.wikipedia.org/wiki/Фосфор
V. Рефлексія
Пройшовши шляхом пізнання ,ми дійшли висновку, що людина має ставитися з добротою, любов’ю до всього живого заради життя на Землі. Потрібно, щоб кожна людина чула ніжну пісню лісових дзвіночків, шелест листочків, пісню жайворонка, відчувала неповторний запах землі.
Любов до природи, до батьківської хати, до неньки - України треба пронести через усе життя.
Встаньте, люди, миром за природу,
За предвічну матінку для нас.
Щедрії дари і чисту воду
Нам вона сторицею віддасть.
(П. Парасочко)
Домашнє завдання.
1.Виконайте завдання за пунктами плану (кожному індивідуально) для створення лепбуку.
2. Виконати тестові завдання за посиланням у Classtime
Тестові завдання
1. Визначте ступінь окиснення Фосфору у сполуці, яка утворюється у процесі згоряння фосфору в надлишку кисню:
А) +3 Б) +5 В) -3 Г) +1
2.Укажіть речовину, що самозаймається на повітрі за звичайних умов:
А) фосфор (V) оксид Б) білий фосфор В) червоний фосфор Г) чорний фосфор
3. Укажіть сировину для промислового добування фосфору:
А) апатит Б) фосфор (V) оксид
В) ортофосфатна кислота Г) метафосфатна кислота
4. Оберіть загальну назву двозаміщених солей ортофосфатної кислоти:
А) ортофосфати Б) гідрогенортофосфати
В) дигідрогенортофосфати Г) гідрогенметафосфати
5. Виберіть властивості, характерні для Фосфору:
А)окисні Б) окисні і відновні В) відновні Г) кислотні
6. Позначте алотропну модифікацію, утворену Фосфором, що являє собою воскоподібну речовину:
А)червоний фосфор Б)чорний фосфор В) білий фосфор Г) фіолетовий фосфор
7. Позначте тип кристалічної гратки білого фосфору:
А) атомна Б) молекулярна В) йонна Г) металічна
8. Укажіть металічний елемент, який входить до складу нерозчинного у воді фосфату:
А) Na Б) Ca в) S г) N
9. Вкажіть зовнішній ефект якісної реакції:
3Ag+ + PO43- → Ag3PO4
А) Б)
Б)  В)
В) Г)
Г)
10. Укажіть технічну назву подрібненого кальцій ортофосфату, який використовують як добриво:
А) фосфоритне борошно
Б) апатитове борошно
В) амофос
Г) кісткове борошно.
11.Установіть відповідність між вихідними речовинами і продуктами їх взаємодії:
1. CaO + P2O5 → А. Ca3(PO4)2
2. CaO + H3PO4 → Б. Ca3(PO4)2 + 6H2O
3. 3Ca(OH)2 + 2H3PO4 → В. Ca(PO3)2 + H2O
4. Ca(OH)2 + P2O5 → Г. Ca(PO3)2
Д. CaHPO4 + H2O
(відповідь: 1 - Г, 2 – Д, 3 – Б, 4 – В)
12. Установіть генетичний ланцюжок добування натрій ортофосфату:
А. P4O10
Б. H3PO4
В. Na3PO4
Г. P4


про публікацію авторської розробки
Додати розробку
